COMITÊ DE ÉTICA EM PESQUISA - CEP-HU CAS/UFJF
HOSPITAL UNIVERSITÁRIO
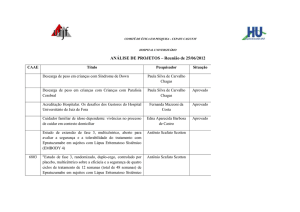
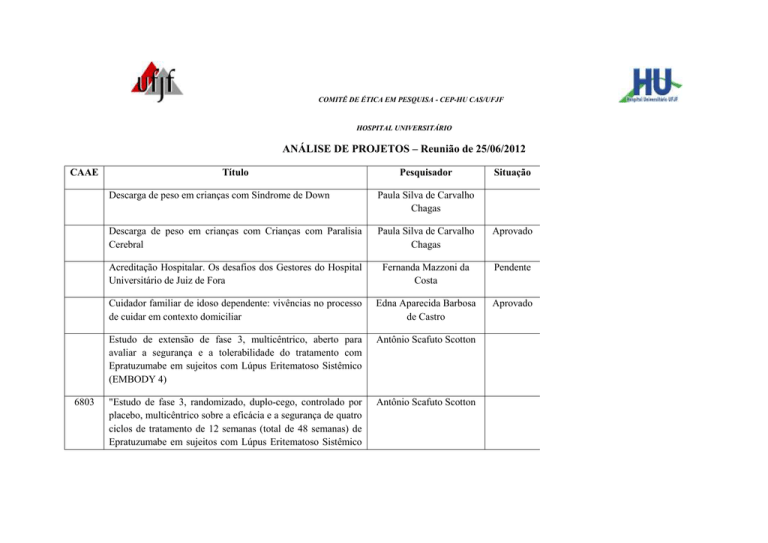
ANÁLISE DE PROJETOS – Reunião de 25/06/2012
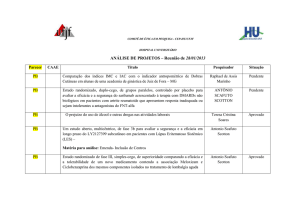
CAAE
6803
Título
Pesquisador
Situação
Descarga de peso em crianças com Síndrome de Down
Paula Silva de Carvalho
Chagas
Descarga de peso em crianças com Crianças com Paralisia
Cerebral
Paula Silva de Carvalho
Chagas
Aprovado
Acreditação Hospitalar. Os desafios dos Gestores do Hospital
Universitário de Juiz de Fora
Fernanda Mazzoni da
Costa
Pendente
Cuidador familiar de idoso dependente: vivências no processo
de cuidar em contexto domiciliar
Edna Aparecida Barbosa
de Castro
Aprovado
Estudo de extensão de fase 3, multicêntrico, aberto para
avaliar a segurança e a tolerabilidade do tratamento com
Epratuzumabe em sujeitos com Lúpus Eritematoso Sistêmico
(EMBODY 4)
Antônio Scafuto Scotton
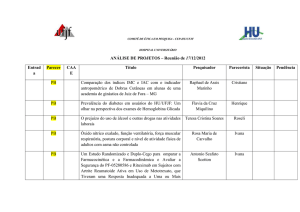
"Estudo de fase 3, randomizado, duplo-cego, controlado por
placebo, multicêntrico sobre a eficácia e a segurança de quatro
ciclos de tratamento de 12 semanas (total de 48 semanas) de
Epratuzumabe em sujeitos com Lúpus Eritematoso Sistêmico
Antônio Scafuto Scotton
com doença moderada a grave. (EMBODY 2)
Matéria para análise: SL0010 - TCLE_Brasil_versão
1.1_26Jul2011;
SL0010
TCLE_Brasil_versão
1.3_21Dez2011.
6803
"Estudo de fase 3, randomizado, duplo-cego, controlado por
placebo, multicêntrico sobre a eficácia e a segurança de quatro
ciclos de tratamento de 12 semanas (total de 48 semanas) de
Epratuzumabe em sujeitos com Lúpus Eritematoso Sistêmico
com doença moderada a grave. (EMBODY 2)
Antônio Scafuto Scotton
Matéria para análise: Emenda 1 ao protocolo do estudo
versão de 22/11/2011; Resumo de alterações da Brochura do
Investigador à versão anterior datada de 13/07/2010; Brochura
do Investigador versão de 14/07/2011; Termo de
Consentimento livre e esclarecido versão 2.3 de 20/03/2012;
Termo de Consentimento livre e Esclarecido Genético versão
2.0 de 09-dec-2012.
0117
PO6129: Estudo aberto para avaliar a adição de Golimumabe
(GLM) subcutâneo a um tratamento convencional com droga
antirreumática modificadora da doença (DMARD) em
indivíduos com artrite reumatóide sem tratamento anterior
com biológicos (Parte 1), seguido de um estudo randomizado
de avaliação do valor da administração combinada de GLM
Endovenosa e subcutânea visando a Indução e manutenção da
remissão (Parte 2).”
Antônio Scafuto Scotton
Matéria para análise: Carta referente a fusão da Mercck
Sharp & Dohme Corp e da Schering-Plough.
0024
Saúde do Trabalhor de Hospital Universitário: Contribuições
Edelvais Keller
teóricas e metodológicas para a saúde mental no trabalho
numa perspectiva da psicodinâmica do trabalho
Matéria para análise: Solicitação de alteração na
metodologia, cronograma, grupos de sujeitos e exclusão e
inclusão de pesquisadores participantes.
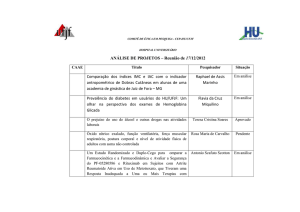
0075
BI 205.418 - "Estudo fase 3, randomizado, duplo-cego,
controlado por placebo, em grupos paralelos, para avaliar a
eficácia e segurança da solução inalatória de tiotrópio
administrada por meio do inalador Respimat (2,5 e 5 mcg,
uma vez ao dia) comparada com placebo e salmeterol em
aerossol dosimetrado HFA (50 mcg, duas vezes ao dia) ao
longo de 24 semanas em pacientes com asma persistente
moderada.”
Júlio César Abreu de
Oliveira
Aprovado
Júlio César Abreu de
Oliveira
Aprovado
Marcus Gomes Bastos
Aprovado
Matéria para análise: Protocolo do estudo versão 3.0 de 05
de dezembro de 2011 e protocolo do estudo versão 3.0 de 05
de dezembro de 2011 - documento de controle das
modificações do protocolo.
0062
Ensaio Clínico multicêntrico, fase III, randomizado, aberto,
comparativo das combinações fixas de formoterol +
fluticasona, para avaliação da eficácia e segurança em
portadores de doença pulmonar obstrutiva crônica (DPOC)
moderada ou grave.
Matéria para análise: Arquivamento de Estudo Clínico
1180
Um estudo randomizado, controlado, aberto, multicêntrico, de
grupo paralelo para avaliar todas as causas de mortalidade e a
morbidade cardiovascular em pacientes com doença renal
crônica em diálise e pacientes não recebendo terapia renal
substitutiva, em tratamento com MIRCERA® ou com agentes
estimulantes da eritropoiese de referência.
Matéria para análise: Brochura do Investigador
0062
"Ensaio Clínico multicêntrico, fase III, randomizado, aberto,
comparativo das combinações fixas de formoterol +
fluticasona e de salmeterol + fluticasona, para avaliação da
eficácia e segurança em portadores de doença pulmonar
obstrutiva crônica (DPOC) moderada ou grave.”
Júlio César Abreu de
Oliveira
Aprovado
Júlio César Abreu de
Oliveira
Aprovado
Matéria para análise: Comunicado informando que o projeto
foi arquivado pela ANVISA
0075
BI 205.418 - "Estudo fase 3, randomizado, duplo-cego,
controlado por placebo, em grupos paralelos, para avaliar a
eficácia e segurança da solução inalatória de tiotrópio
administrada por meio do inalador Respimat (2,5 e 5 mcg,
uma vez ao dia) comparada com placebo e salmeterol em
aerossol dosimetrado HFA (50 mcg, duas vezes ao dia) ao
longo de 24 semanas em pacientes com asma persistente
moderada.”
Matéria para análise: Páginas referente ao protocolo
supracitado que não constatavam inclusas no mesmo. Tais
páginas referem aos números de páginas 159 e 160 do capítulo
11 do estudo.
001011
Avaliação da resposta emocional em pacientes comatosos
Matéria para análise: Alteração do cronograma; Alteração na
Planilha de Avaliação; TCLE será assinado pelo represente
legal do paciente em como
Antenor Salzer Rodrigues
2271
PEARL-SC - "Um estudo de extensão aberto, de segurança a
longo prazo para sujeitos com Lúpus Eritematoso Sistêmico
que concluiram o protocolo NA-SLE3321."
Antônio Scafuto Scotton
Matéria para análise: Carta Administrativa – 17 de maio de
2012
2271
PEARL-SC - "Um estudo de extensão aberto, de segurança a
longo prazo para sujeitos com Lúpus Eritematoso Sistêmico
que concluiram o protocolo NA-SLE3321."
Antônio Scafuto Scotton
Matéria para análise: Apêndice 1; Apêndice 1; Brochura do
Investigador; (inglês); Brochura do Investigador(português);
Protocolo Clínico, Emenda 1 (Inglês); Protocolo Clínico,
Emenda 1 (Português); Resumo das Alterações ao Protocolo;
Emenda 1 (Inglês); Resumo das Alterações ao Protocolo;
Emenda 1 (português); Resumo das alterações da Brochura do
Investigador (Inglês); Resumo das Alterações da Brochura do
Investigador (Português); TCLE; TCLE, Versão 2.0 de 20 de
Abril de 2012 (Versão em Português)
0070
Estudo fase 3, randomizado, duplo-cego, contrlado por
placebo do Tasquinimod em homens com câncer da próstata
metas tático resistente à castração.
Christiane Maria Meurer
Alves
Matéria para análise: Protocolo versão 03 incluindo a
Emenda Global 2.0 de 20 de março de 2012.
0034
Protocolo H9B-MC-BCDM - "Estudo de fase 3, multicêntrico,
randomizado, duplo-cego e controlado por placebo para
avaliação da eficácia e segurança de LY2127399 em pacientes
com artrite reumatóide (RA) moderada a grave que
apresentam resposta inadequada à terapia com metotrexato.”
Antônio Scafuto Scotton
Matéria para análise: Guia de Consentimento Livre e
Esclarecido (segunda tradução para o Brasil - versão 1.0 de
05/01/2011 - v01_bra (PT)_v2.
1469
" Estudo de extensão, não controlado, multicêntrico avaliando
a eficácia e a segurança de SAR153191 além de DMARDs em
pacientes com artrite reumatóide (RA)." Protocolo LTS11210
Antônio Scafuto Scotton
Matéria para análise: Carta referente às precauções trauma
local e infecções datada de 12/04/2012
0673
MOBILITY - "Um estudo randomizado, duplo-cego,
controlado por placebo, multicêntrico, de duas partes, de
variação de dose e confirmatória com um desenho
operacionalmente adaptativo, para avaliar a eficácia e
segurança do SAR153191 além de metotrexato (MTX) em
pacientes com artrite reumatóide ativa que responderam de
forma inadequada à terapia com MTX.”
Antônio Scafuto Scotton
Matéria para análise: Carta referente às precauções trauma
local e infecções datada de 12/04/2012
1093
"Estudo fase IIB, randomizado, multicêntrico, duplo-cego, de
amplitude de dosagem, controlado por placebo/medicamento
ativo para avaliar a eficácia e segurança da injeção subcutânea
de BMS-945429 com ou sem metotrexato em pacientes com
Artrite Reumatóide moderada a severa com resposta
inadequada a Metotrexato (IM133-001).”
Antônio Scafuto Scotton
Matéria para análise: TCLE versão 4.0, datado de
06/06/2012
0673
MOBILITY- Um estudo randomizado, duplo-cego, controlado
por placebo, multicêntrico, de duas partes, de variação de dose
Antônio Scafuto Scotton
Aprovado
e confirmatória com desempenho operacionalmente
adaptativo, para avaliar a eficácia e segurança do SAR153191
além de metotrexato (MTX) em pacientes com artrite
reumatóide ativa que responderam de forma inadequada à
terapia com MTX
Matéria para análise: Eventos Adversos Sérios
1093
Estudo Fase IIB, Randomizado, Multicêntrico, Duplo-Cego,
de
Amplitude
de
Dosagem,
Controlado
por
Placebo/Medicamento Ativo para Avaliar a Eficácia e
Segurança da Injeção Subcutânea de BMS-945429 com ou
sem Metotrexato em Pacientes com Artrite Reumatoide
Moderada a Severa com Resposta Inadequada a Metotrexato
Antônio Scafuto Scotton
Aprovado
Antônio Scafuto Scotton
Aprovado
Antônio Scafuto Scotton
Aprovado
Matéria para análise: Notificação ao CEP (não considerar
desvios pois os TCLEs foram preenchidos posteriormente sem
prejuízo ao protocolo e aos pacientes)
0265
WA22762 - Um estudo de grupo paralelo, randomizado,
duplo-cego da segurança e do efeito no resultado clínico do
tocilizumabe SC versus tocilizumabe IV, em combinação com
tradicionais medicamentos antireumáticos modificadores do
curso da doença (DMARDs), em pacientes com artrite
reunatóide ativa de moderada a grave.
Matéria para análise: Desvios de protocolo; Eventos
Adversos Sérios
0446
Um estudo fase 3, duplo-cego, duplo-simulado, Multicêntrico,
Prospectivo, Randomizado da Eficácia e Segurança dos
Comprimidos de LCP-TacroTM, uma vez ao dia comparado
às cápulas de Prograf, duas vezes ao dia, em combinação com
Micofenolato Mofetil na Prevenção da Rejeição Aguda do
Aloenxerto em pacientes adultos de Transplanmete Renal de
Novo
Matéria para análise: II Relatório Semestral; Cronograma do
Estudo, datado de 15 de dezembro de 2011
1180
Um estudo randomizado, controlado, aberto, multicêntrico, de
grupo paralelo, para avaliar todas as causas de mortalidade e
morbidade cardiovascular em pacientes com doença renal
crônica em diálise e pacientes não recebendo terapia renal
substitutiva em tratamento com MIRCERA ou agentes
estimulantes de eritropoiese de referência – BH201260
(R0503821)
Marcus Gomes Bastos
Aprovado
Marcus Gomes Bastos
Aprovado
Antônio Scafuto Scotton
Aprovado
Matéria para análise: Errata sobre as cartas de ciência do
CEP referente aos Eventos Adversos Sérios
1180
Um estudo randomizado, controlado, aberto, multicêntrico, de
grupo paralelo para avaliar todas as causas de mortalidade e a
morbidade cardiovascular em pacientes com doença renal
crônica em diálise e pacientes não recebendo terapia renal
substitutiva, em tratamento com MIRCERA® ou com agentes
estimulantes da eritropoiese de referência.
Matéria para análise: Evento Adverso Sério
0117
PO6129: Estudo aberto para avaliar a adição de Golimumabe
(GLM) subcutâneo a um tratamento convencional com droga
antirreumática modificadora da doença (DMARD) em
indivíduos com artrite reumatóide sem tratamento anterior
com biológicos (Parte 1), seguido de um estudo randomizado
de avaliação do valor da administração combinada de GLM
endovenosa e subcutânea visando a indução e manutenção da
remissão (parte 2).”
Matéria para análise: Evento Adverso Sério e Desvio de
protocolo
1277
CD-IA-MEDI-545-1067/D2800L00004 - Estudo de fase 2b,
de determinação de faixa posológica para avaliar a eficácia e
segurança de Sifalimumab em adultos com Lúpus Eritematoso
Sistêmico.
Antônio Scafuto Scotton
Aprovado
Antônio Scafuto Scotton
Aprovado
Antônio Scafuto Scotton
Aprovado
Antônio Scafuto Scotton
Aprovado
Matéria para análise: Material de Divulgação do estudo CDIA-MEDI-545-1067 (LES) versão 1 de 29/05/2012.
0673
MOBILITY - "Um estudo randomizado, duplo-cego,
controlado por placebo, multicêntrico, de duas partes, de
variação de dose e confirmatória com um desenho
operacionalmente adaptativo, para avaliar a eficácia e
segurança do SAR153191 além de metotrexato (MTX) em
pacientes com artrite reumatóide ativa que responderam de
forma inadequada à terapia com MTX”.
Matéria para análise: Modelo do Cartão do paciente –
versão 3 de 03/05/2012 para o estudo SARIL-RA-MOBILITY
0070
"Estudo fase 3, randomizado, duplo-cego, contrlado por
placebo do Tasquinimod em homens com câncer da próstata
metas tático resistente à castração."
Matéria para análise: Diário do paciente (denominado Diário
de Uso de medicação).
0070
"Estudo fase 3, randomizado, duplo-cego, contrlado por
placebo do Tasquinimod em homens com câncer da próstata
metas tático resistente à castração."
Matéria para análise: Desvio de protocolo
1469
" Estudo de extensão, não controlado, multicêntrico avaliando
a eficácia e a segurança de SAR153191 além de DMARDs em
pacientes com artrite reumatóide (RA)." Protocolo LTS11210
Antônio Scafuto Scotton
Aprovado
Antônio Scafuto Scotton
Aprovado
Antônio Scafuto Scotton
Aprovado
Antônio Scafuto Scotton
Aprovado
Matéria para análise: Modelo do Cartão do paciente versão 3
de 07/05/2012.
0117
PO6129: Estudo aberto para avaliar a adição de Golimumabe
(GLM) subcutâneo a um tratamento convencional com droga
antirreumática modificadora da doença (DMARD) em
indivíduos com artrite reumatóide sem tratamento anterior
com biológicos (Parte 1), seguido de um estudo randomizado
de avaliação do valor da administração combinada de GLM
endovenosa e subcutânea visando a indução e manutenção da
remissão (Parte 2).
Matéria para análise: Relatório Final do protocolo
1092
Um estudo randomizado, duplo-cego, de grupo paralelo, de
segurança e do efeito sobre o desfecho clínico de tocilizumabe
SC versus placebo SC em combinação com medicamentos
antirreumáticos modificadores da artrite reumatóide
tradicionais (DMARDs) em pacientes com artrite reumatóide
ativa de grau moderado a grave.
Matéria para análise: Eventos Adversos Sérios
0186
Estudo Pearl-SC, Protocolo AN-SLE3321- Um estudo de fase
2B, randomizado e duplo-cego para avaliar a eficácia, a
segurança e a tolerabilidade da administração do A-623 em
Pacientes com Lúpus Eritematoso Sistêmico
Matéria para análise: Eventos Adversos Sérios
0034
Estudo de fase 3,multicêntrico, randomizado, duplo-cego e
controlado por placebo para avaliação da eficácia e segurança
de LY2127399 em pacientes com artrite reumatóide (RA)
moderada à grave que apresentaram resposta inadequada à
terapia com metotrexato
Antônio Scafuto Scotton
Aprovado
Antônio Scafuto Scotton
Aprovado
Antônio Scafuto Scotton
Aprovado
Antônio Scafuto Scotton
Aprovado
Matéria para análise: Eventos Adversos Sérios
0032
Estudo de Fase 3, multicêntrico, randomizado, duplo-cego e
controlado por placebo para avalição da eficácia e segurança
de LY2127399 em pacientes com artrite reumatoide (RA)
moderada a grave que apresentaram resposta inadequada a um
ou mais inibidores de TNF- ά
Matéria para análise: Eventos Adversos Sérios; Desvio de
protocolo.
0033
Estudo de fase 3b, multicêntrico e aberto para avaliação da
segurança e eficácia crônicade LY2127399 em pacientes que
apresentam artrite reumatóide (RA)
Matéria para análise: Eventos Adversos Sérios
1199
Um estudo multicêntrico, randomizado, duplo-cego, de grupo
paralelo para a segurança, remissão da doença e prevenção de
dano estrutural na articulação durante o tratamento com
tocilizumabe (TCZ), como monoterapia e em combinação com
metotrexato (MXT), versus metotrexato, em pacientes com
artrite reumatóide na fase inicial, de moderada a severa.
Matéria para análise:
Esclarecimento sobre a paciente 12259;
Solicitação de correção do parecer 311/2010;
Solicitação de correção na carta de aprovação da emenda C;
Solicitação de esclarecimento sobre alteração de nº de
protocolo;
Solicitação de correção do parecer 285/2011
Eventos Adversos Sérios
0329
ML21530 - Estudo aberto de braço único sobre a segurança e
redução de sinais e sintomas durante o tratamento com
Tocilizumabe em combinação com Metotrexato em pacientes
com Artrite Reumatóide ativa, moderada a grave”.
Antônio Scafuto Scotton
Aprovado
Júlio César Abreu de
Oliveira
Aprovado
Matéria para análise: Eventos Adversos Sérios
0075
Estudo de fase 3, randomizado, duplo-cego, controlado por
placebo, em grupos paralelos, para avaliar a eficácia e
segurança da solução inalatória de tiotrópio administrada por
meio do inalador Respimat® ( 2,5 e 5 mcg, uma vez ao dia)
comprada com placedo e salmeterol em aerossol dosimetrado
HFA (50 mcg, duas vezes ao dia) ao longo de 24 semanas em
pacientes com asma persistente moderação.
Matéria para análise: Eventos Adversos Sérios