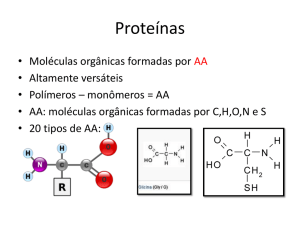
Enzimas regulatórias no controle do metabolismo 1
1. Introdução
A regulação do metabolismo é fundamental para que um organismo possa responder de
modo rápido e eficiente a variações das condições ambientais, alimentares ou ainda a
condições adversas como traumas e patologias.
As enzimas são em sua maioria proteínas. Possuem alta especificidade, podendo ter
atividade intra ou extracelular. As enzimas são catalisadores das reações bioquímicas, isto é,
atuam tornando possível uma nova reação com energia de ativação menor. Geralmente elas
aumentam a velocidade da reação por um fator de 105 a 1017. Isso significa que simplesmente
com a sua presença, e sem serem consumidas durante o processo, conseguem acelerar reações
bioquímicas. As enzimas são sintetizadas por células vivas e atuam em quase todas as reações
químicas do metabolismo dos organismos vivos e também estão presentes em vários
alimentos.
A regulação metabólica é feita pela modulação de enzimas regulatórias em processos
metabólicos chaves, de tal modo que se possa ativar ou inibir reações químicas específicas
para cada situação resultando em respostas biológicas adequadas. Para garantir a eficiência
necessária, o organismo lança mão de vários tipos de regulação enzimática que podem ocorrer
simultaneamente. A atividade enzimática pode depender da presença de determinadas
moléculas, os cofatores, que podem participar diretamente ou não da reação. Diversos outros
fatores também podem afetar a atividade enzimática, dentre eles a temperatura, o pH, a
concentração da enzima, do substrato e os inibidores.
2. Cinética enzimática
A cinética de uma enzima é estudada avaliando-se a quantidade de produto
formado ou a quantidade de substrato consumido por unidade de tempo. Uma reação
enzimática pode ser expressa pela seguinte equação:
E + S
[ES]
E+P
1
Gomes, C.W.C. Enzimas regulatórias no controle do metabolismo. Seminário apresentado na disciplina
Bioquímica do Tecido Animal, Programa de Pós-Graduação em Ciências Veterinárias, Universidade Federal do
Rio Grande do Sul, 2014. 10 p.
1
Onde:
E = enzima
S = substrato
P = produto
ES = complexo enzima/substrato
A velocidade de uma reação enzimática depende das concentrações de enzima e
de substrato. A velocidade inicial aumenta com o incremento na concentração do
substrato, quando é mantida constante a concentração da enzima. Esse aumento
continua até o ponto em que se obtém a velocidade máxima, onde se tem a saturação
da enzima. A partir desse ponto a velocidade da reação é mantida constante.
Michaelis e Menten, em 1913, propuseram um modelo de reação enzimática
para apenas um substrato. A partir deste modelo, foi desenvolvida uma equação que
permite demonstrar como a velocidade de uma reação varia com a variação da
concentração do substrato. Esta equação pode ser expressa graficamente, e representa
o efeito da concentração de substrato sobre a velocidade de reação enzimática (Figura
1). Michaelis e Menten deduziram uma constante (KM) que é indicadora da
velocidade da reação e consequentemente do grau de afinidade que a enzima tem pelo
substrato. A constante de Michaelis-Menten (KM) é definida como a concentração de
substrato necessária para que metade da velocidade máxima da reação seja atingida. O
KM de um substrato para uma enzima específica é característico, e fornece um
parâmetro de especificidade deste substrato em relação à enzima. Quanto menor o
KM, maior a especificidade, e quanto maior o KM , menor a especificidade.
Equação de Michaelis e Menten:
Onde: V0 = velocidade inicial
Vmax = velocidade máxima
Km = constante de Michaelis-Menten
[S] = concentração do substrato (em mol/L)
2
Figura 1. Gráfico da equação de Michaelis-Menten.
As enzimas alostéricas mostram relações entre velocidade inicial e concentração
de substrato que diferem do comportamento enzimático do tipo Michaelis-Menten.
Elas exibem saturação quando a concentração do substrato é suficientemente alta, mas
algumas enzimas alostéricas, quando a velocidade inicial é colocada em gráfico
contra a concentração do substrato, resultam em uma curva de saturação sigmóide e
não uma curva hiperbólica. Na curva de saturação sigmóide (Figura 2) verifica-se
uma valor da concentração de substrato no qual a velocidade inicial é metade da
velocidade máxima, mas que não é designado como KM.
Figura 2. Curva sigmóide de uma enzima alostérica.
O comportamento da cinética sigmóide em geral reflete interações cooperativas
entre subunidades protéicas. Mudanças na estrutura de uma subunidade são
convertidas em mudanças estruturais nas subunidades adjacentes, um efeito mediado
3
por interações não covalentes. As enzimas alostéricas mostram diferentes respostas
em suas curvas de variação da atividade em função da concentração do substrato
porque algumas possuem moduladores inibidores, outras moduladores ativadores e
várias possuem os dois tipos.
3. Enzimas regulatórias
No metabolismo celular, grupos de enzimas trabalham juntos em sequência para
conduzir um dado processo metabólico. Nestes sistemas enzimáticos, o produto da
reação de uma enzima torna-se o substrato da próxima enzima. Cada via metabólica
possui uma ou mais enzimas com maior efeito no ritmo geral do processo, as enzimas
regulatórias. Estas enzimas exibem atividade catalítica reduzida ou aumentada, em
resposta a certos sinais, controlam a velocidade das reações e assim o ritmo de todo o
processo metabólico, permitindo à célula adaptar-se de acordo com as necessidades.
Enzimas alostéricas
Enzimas alostéricas são enzimas que contem uma região separada daquela em
que se liga o substrato, na qual pequenas moléculas regulatórias podem se ligar e
modificar a atividade catalítica destas enzimas. As modificações no sítio catalítico
podem diminuir ou acelerar a velocidade da reação. Muitas enzimas alostéricas estão
localizadas em um ponto de ramificação, ou próximo a ele, em uma via metabólica,
influenciando no direcionamento de substratos para uma ou outra via disponível.
Essas enzimas não seguem a cinética de Michaelis-Menten. Sua curva de saturação é
sigmóide, assim como a de qualquer proteína alostérica. Normalmente estas enzimas
são inibidas pelo produto final da via metabólica (inibição por feedback). Muitas
enzimas alostéricas respondem a múltiplos efetores que interferem na velocidade
máxima e na constante de Michaelis-Menten.
Modificação covalente e outros
Algumas enzimas tem suas atividades catalíticas regulada por modificações
covalentes em um ou mais dos resíduos de aminoácidos da molécula da enzima. Essas
4
sofrem processos reversíveis de fosforilação (adição de um grupo fosfato), adenilação
(adição de um AMP), uridilação (adição de um UMP), ADP-ribosilação (adição de
ADP-ribose), metilação (adição de um grupo metila), entre outros. A modificação de
uma enzima faz com que um novo resíduo de aminoácido com propriedades
diferentes seja introduzido na enzima. A introdução de uma carga pode alterar as
propriedades locais da enzima e introduzir uma mudança na conformação.
Normalmente essas mudanças são substanciais e podem ser críticas para a função da
enzima alterada. Um exemplo frequente é a transferência de um grupo fosfato,
proveniente do ATP, para a enzima alvo. Naturalmente a presença dos grupos fosfato
acarreta mudança da conformação espacial da enzima, com duas consequências
possíveis: nova conformação cataliticamente inativa ou formação de um sítio ativo
funcional. Assim quando várias enzimas são fosforiladas simultaneamente, o
metabolismo é drasticamente alterado.
Também existem regulações enzimáticas através de proteínas que se unem as
enzimas para inibir ou estimular sua atividade; e clivagem proteolítica de certas
enzimas como indução da sua atividade. A necessidade e presença de cofatores
enzimáticos também atua na regulação da atividade catalítica.
4. Inibidores enzimáticos
Os inibidores de enzimas são moléculas que interferem com a catálise,
diminuindo ou interrompendo as reações enzimáticas. Eles se ligam as enzimas,
temporária ou definitivamente, impedindo que elas se liguem ao substrato. Muitos
tipos de moléculas inibem as enzimas, incluindo drogas e agentes tóxicos, e podem
agir de várias formas. A atividade de inibição enzimática atua como um mecanismo
de controle dos sistemas biológicos.
Inibidores reversíveis
A inibição reversível é caracterizada por uma rápida dissociação do complexo
enzima-inibidor (Figura 3). Existem dois tipos de inibição reversível, a competitiva e
a não competitiva.
5
O inibidor competitivo assemelha estruturalmente ao substrato e liga-se ao sítio
ativo da enzima, impedindo assim o substrato de se ligar ao mesmo local. Muitos
inibidores competitivos tem estrutura similar à estrutura do substrato. Entretanto
faltam grupos químicos no inibidor que possam dar continuidade a reação, fazendo
com que sua presença apenas gere uma competição com as moléculas do substrato.
Um inibidor competitivo diminui a taxa de catálise por reduzir a proporção de
moléculas de enzima ligadas a um substrato. Em qualquer concentração do inibidor, a
inibição competitiva pode ser diminuída através do aumento da concentração de
substrato. Sob estas condições, o substrato compete com o inibidor pelo sítio ativo.
Na inibição competitiva, uma enzima pode ligar-se ao substrato ou ao inibidor, mas
não ambos. O complexo enzima-inibidor não gera nenhum produto.
Na inibição reversível não competitiva, o inibidor e o substrato podem
simultaneamente ligar-se a uma molécula de enzima em diferentes locais de ligação.
Um inibidor não-competitivo se liga a um local diferente do sítio ativo da enzima,
pois não há semelhança estrutural entre ele e o substrato. Age induzindo uma
mudança conformacional na enzima, diminuindo a taxa de formação do complexo
enzima-substrato ou reduzindo a taxa de degradação desse complexo para formar o
produto. Enquanto a enzima estiver ligada ao inibidor, nenhum produto será formado.
A inibição não competitiva, em contraste com a inibição competitiva, não pode ser
superada pelo aumento da concentração de substrato. Na prática, a inibição não
competitiva é observada apenas em enzimas com dois ou mais substratos.
Figura 3. Modelos de inibidores reversíveis.
6
Inibidores irreversíveis
Na inibição enzimática irreversível há uma ligação covalente com a enzima,
causando uma modificação definitiva no sítio de ligação ou no sítio catalítico da
enzima, formando complexos inativos. Também pode atuar destruindo um grupo
funcional da enzima que é essencial pra sua atividade ou formando uma associação
não covalente estável.
5. Controle do metabolismo
O crescimento e a sobrevivência da célula dependem do uso eficiente dos
recursos. Esta eficiência é possível graças às enzimas regulatórias. As células
precisam alterar continuamente seu ritmo e atividade metabólica de acordo com suas
necessidades e condições. Na maioria dos sistemas multienzimáticos, a primeira
enzima da sequência é a regulatória. Isso torna o controle do processo mais efetivo,
pois a catálise das primeiras reações da sequência que leva até um produto
desnecessário desvia a energia e os metabólitos para processos mais importantes.
A atividade das enzimas regulatórias ocorre de várias formas. As enzimas
alostéricas funcionam através de ligações não covalentes e reversíveis. Outras
enzimas são reguladas por modificação reversível de sua polaridade. Ambas as
classes de enzimas regulatórias costumam ser subunidades de proteínas e, em alguns
casos, o sítio regulatório e o sítio ativo encontram-se em subunidades separadas.
Algumas enzimas são estimuladas ou inibidas quando estão ligadas por proteínas
regulatórias. Outras são ativadas quando segmentos de peptídeos são removidos por
clivagem proteolítica, que é irreversível. Estes mecanismos ocorrem em processos
fisiológicos como digestão, coagulação sanguínea, atividade hormonal e visão.
Controle fisiológico
Em alguns sistemas multienzimáticos, a enzima regulatória é especificamente
inibida pelo produto final da rota metabólica. Quando a velocidade da atividade de tal
enzima é reduzida, todas as enzimas subsequentes trabalham em ritmo mais lento,
7
uma vez que seus substratos estão esgotados. A taxa de produção do produto final é
equilibrada com as necessidades da célula. Este tipo de regulação chama-se inibição
feedback. Este é um exemplo na conversão do aminoácido L-treonina em Lisoleucina, catalisada por uma sequência de cinco enzimas.
Em outra classe importante de enzimas regulatórias, a atividade é regulada por
mudança de polaridade, através de grupos reguladores como fosforil, adenilil, uridilil,
metil e grupos de adenosina difosfato ribosil. Fosforilação é a adição de um grupo
fosfato (PO4) a uma proteína ou outra molécula. A fosforilação é um dos principais
participantes nos mecanismos de regulação das proteínas, de um terço a metade de
todas as proteínas em células eucarióticas são fosforiladas. Esta forma de controle
regulatório é essencial em um grande número de vias regulatórias. Um exemplo
importante deste controle enzimático por fosforilação ocorre na glicogêniofosforilase, enzima responsável por uma das etapas da glicogenólise, nos músculos e
no fígado. A fosforilase como enzima alostérica tem metabólitos reguladores que a
fosforilam ou a desfosforilam, que são realizados por duas enzimas, fosforilasequinase e fosforilase-fosfatase. Essas enzimas são reguladas pela adrenalina, glucagon
e insulina, e, portanto, esses elementos contribuem no controle da glicogenólise. Um
exemplo de enzima regulada por metilação é a proteína aceptora de metilas da
quimiotaxia de bactérias. Essa proteína é parte de um sistema que permite as bactérias
de irem em direção de um atraente ou se afastarem de um repelente químico. O agente
metilante é a S-adenosilmetionina.
Certas enzimas, cujo local de ação é extracelular, são sintetizadas na forma de
precursores inativos, chamado zimogênios. Para que um zimogênio se torne ativo é
preciso que ocorra hidrólise de determinadas ligações peptídicas, com a consequente
remoção de um segmento da cadeia e nova reestruturação espacial, onde aparecerá um
sítio ativo funcional. Várias enzimas proteolíticas são sintetizadas e armazenadas
como zimogênios, transformadas em enzimas somente fora destas células e no local
onde exercerão atividade digestiva. Muitas enzimas proteolíticas são reguladas desta
forma, por clivagem proteolítica. Quimotripsina e tripsina são inicialmente
sintetizadas como quimotripsinogênio e tripsinogênio.
A glutamina é a doadora do grupo amina para a formação de vários produtos e
também funciona como um estoque de amônia nos animais. A glutamina sintetase de
mamíferos é ativada por α-cetoglutarato, o produto da desaminação oxidativa do
glutamato. Este controle previne a acumulação da amônia produzida pela reação. A
8
glutamina sintetase bacteriana tem um controle muito mais elaborado. Nove
inibidores
alostéricos
por
feedback
(histidina,
triptofano,
carbamil-fosfato,
glicosamino-6-fosfato, AMP e CTP), cada um com seu sítio de ligação, controlam a
atividade da enzima. A glutamina sintetase é covalentemente modificada por
adenilação de um resíduo específico de tirosina, aumentando sua susceptibilidade à
inibição por feedback, ou seja, a enzima fica menos ativa.
Controle farmacológico
Alguns fármacos atuam como inibidores catalíticos. Antimicrobianos betalactâmicos, como a penicilina e amoxicilina, atuam através de ligação covalente
modificando a enzima transpeptidase, impedindo a síntese da parede celular das
bactérias. O ácido acetilsalicílico tem ação parecida. Inibe diretamente a atividade da
enzima cicloxigenase (COX) para diminuir a formação dos precursores das
prostaglandinas e dos tromboxanos a partir do ácido araquidónico, reduzindo a
produção de sintomas inflamatórios.
Outros fármacos como captopril, enalapril e lisinopril agem inibindo as enzimas
conversoras de angiotensina (ECA). Essas drogas diminuem a pressão sanguínea por
bloquear a enzima que cliva a angiotensina I para formar a angiotensina II, um
potente vasoconstritor.
6. Conclusão
A regulação do metabolismo é fundamental para que um organismo possa se
adaptar as variações fisiológicas e patológicas. As células precisam alterar
continuamente seu ritmo e atividade metabólica de acordo com suas necessidades e
condições. Essa regulação é feita pela modulação de enzimas regulatórias em
processos metabólicos chaves, resultando em respostas biológicas adequadas. Para
garantir a eficiência necessária, o organismo lança mão de vários tipos de regulação
enzimática que podem ocorrer simultaneamente. Além do controle fisiológico,
diversos fármacos podem atuar de maneira semelhante, na tentativa de controlar e
evitar reações indesejáveis.
9
Referências
GONZÁLEZ, F.H.D.; SILVA, S.C. Introdução à bioquímica veterinária. 2ª edição. Porto Alegre:
Editora da Universidade Federal do Rio Grande do Sul. 2006.
HARVEY, R.A. Bioquímica ilustrada. 5º Ed. Porto Alegre: Artmed, 2012.
MARQUES, R.B.O.; YAMANAKA, H. Biossensores baseados no processo de inibição enzimática.
Química Nova, v. 31, p. 1791-1799, 2008.
MARZZOCO, A.; TORRES, B.B. Bioquímica básica. 3ª Ed. Rio de Janeiro: Guanabara-Koogan, 2007.
NELSON, D.L.; COX, M. M.Princípios de Bioquímica de Lehninger. 5º Ed. Porto Alegre: Artmed,
2011.
10