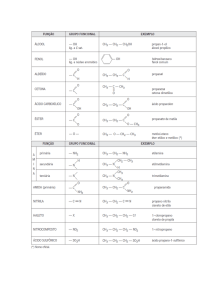
MÁXIMO VESTIBULARES
QUÍMICA
PROFª HAIRA
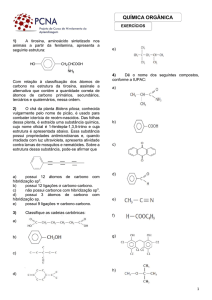
Tipo de isomeria em que uma molécula tem uma
imagem especular (“reflexo”) diferente de si mesma.
Estas moléculas especulares diferentes são
chamadas de “isômeros ópticos”, “enantiomorfos”
ou “enantiômeros”.
É um caso sutil de isomeria, muito difícil de ser
detectado, que ocorre com moléculas sem nenhum
plano de simetria.
Ex: Ácido lático
Molécula de ácido lático objeto
X
Molécula de ácido lático imagem
Mão direita
(luva para mão direita)
X
Mão esquerda
(luva para mão esquerda)
Molécula assimétrica (ou quiral) - não apresenta
plano de simetria e, portanto, possui uma
“molécula-imagem” que é diferente de si mesma.
Molécula simétrica (ou aquiral) - apresenta plano
de simetria e, portanto, possui uma “moléculaimagem” que é igual a si mesma.
Ex: CHFBrCℓ
Sem plano de simetria
Molécula 1 (objeto) ≠ Molécula 2 (imagem)
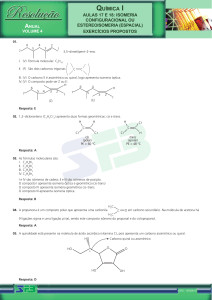
Como saber se uma molécula vai
apresentar um isômero óptico,
ou seja, uma imagem especular
diferente de si mesma?
Deve ter, pelo menos, 1 carbono quiral (assimétrico).
Carbono quiral (C*): carbono que faz 4 ligações
simples com 4 grupos de átomos diferentes entre si. Ex:
Carbono
quiral
Deve ter, pelo menos, 1 carbono quiral (assimétrico).
Carbono quiral (C*): carbono que faz 4 ligações
simples com 4 grupos de átomos diferentes entre si. Ex:
Carbono
quiral
Ex: Ácido lático
Carbono
quiral
Ex: Cadeia cíclica
Carbono
quiral
Ex: Cadeia cíclica
Carbono
quiral
TIPOS DE ISOMERIA ÓPTICA
Enantiômeros: moléculas com carbono quiral que são
exatamente a imagem especular (reflexo) uma da outra.
Diastereoisômeros: moléculas com carbono quiral, mas
que não são exatamente a imagem especular (reflexo)
uma da outra (caso especial).
Enantiômeros:
Diastereoisômeros:
1 e 2; 3 e 4
1 e 3; 1 e 4; 2 e 3; 2 e 4
QUANTIDADE DE ISÔMEROS ÓPTICOS
Isômero ópticos = 2n
n = número de carbonos quirais na molécula
Exemplo:
2n = 21 = 2, então temos 2 isômeros ópticos.
QUANTIDADE DE ISÔMEROS ÓPTICOS
Exemplo:
2n = 22 = 4, então temos 4
isômeros ópticos
Como detectar a presença de
isomeria óptica em uma amostra
de substância orgânica?
Todos os isômeros possuem propriedades físicas
diferentes, tais como PF, PE e densidade.
Mas os isômeros ópticos não possuem esta diferença,
ou seja, as propriedades físicas dos isômeros ópticos
são as mesmas.
Assim, somente podemos diferenciá-los colocando-os
na frente de uma luz polarizada (no “polarizador”).
Os isômeros ópticos são compostos capazes de
desviar a luz polarizada.
Uma lâmpada emite muitas ondas de luz, que vibram em
vários planos (luz não-polarizada).
Lentes (polarizadores) são capazes de fazer essa luz
atravessá-las e sofrer a polarização (vibração em 1 só plano).
Ao colocar dois polarizadores alinhados no caminho da luz
teremos uma luz polarizada.
Passando uma luz polarizada por uma molécula com
isomeria óptica, o plano de vibração da luz sofre um desvio.
Enantiômero Dextrógiro (D, +): provoca o giro da luz
polarizada para a direita (“opticamente ativa”).
Enantiômero Levógiro (L, -): provoca o giro da luz
polarizada para a esquerda (“opticamente ativa”).
Mistura Racêmica: mistura de 50% de dextrógiro com 50%
de levógiro (“opticamente inativa”) → 2n-1 combinações
(n = carbonos quirais)
Observação: a amostra levógira causaria um desvio de - α.
Os isômeros comportam-se de modo diferente quando
envolvidos em reações químicas. Ex:
Talidomida
Prescrita para combater enjôos matinais na década de 60.
Má-formação congênita (“bebês da talidomida" ou "geração
talidomida”).