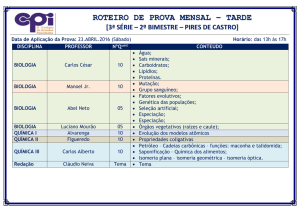
Química Orgânica – Aula 1
(Específica)
ISOMERIA EM QUÍMICA ORGÂNICA
Profº.: Wesley de Paula
ISOMERIA
INTRODUÇÃO
•
•
•
a substância A é um álcool: CH3-CH2-OH;
a substância B é um éter: CH3-O-CH3;
A e B são isômeros.
“Isômeros são compostos de mesma forma molecular que
apresentam propriedades diferentes devido a fórmulas
estruturais diferentes”.
1. ISOMERIA PLANA , ESTRUTURAL OU CONSTITUCIONAL
2. ISOMERIA ESPACIAL OU ESTEREOISOMERIA
ISOMERIA PLANA
“Isomeria plana ocorre quando a diferença entre os
isômeros pode ser explicada por fórmulas estruturais
planas”.
Isomeria de cadeia (ou de núcleo);
Isomeria de posição;
Isomeria de compensação (ou metameria);
Isomeria de função (ou funcional);
Tautomeria.
ISOMERIA DE CADEIA (OU DE NÚCLEO)
“Isomeria de cadeia (ou núcleo)é aquela em que os isômeros têm
cadeias (ou núcleos) diferentes”.
Exemplos:
ISOMERIA DE POSIÇÃO
“Isômeros de posição ocorre quando isômeros têm a mesma cadeia
carbônica, mas diferem pela posição de ramificações ou de ligações duplas
ou triplas”.
ISOMERIA DE COMPENSAÇÃO (OU METAMERIA)
“Isomeria de compensação (ou metameria) ocorre quando os isômeros
diferem pela posição de um heteroátomo na cadeia carbônica”.
ISOMERIA DE FUNÇÃO (OU FUNCIONAL)
“Isomeria de função ou química é o caso de isomeria plana na qual os
isômeros pertencem à funções químicas diferentes.” Os principais casos de
isomeria funcional são:
TAUTOMERIA
“Tautomeria é o caso particular de isomeria funcional em que dois isômeros
ficam em equilíbrio químico dinâmico”.
Os casos mais comuns de tautomeria são entre:
• aldeído e enol;
• cetona e enol.
ISOMERIA ESPACIAL
“Isomeria espacial (ou estereoisomeria) é aquela que somente pode ser
explicada por meio de fórmulas estruturais espaciais”.
A isomeria espacial divide-se em:
2.1. isomeria cis-trans (ou geométrica);
2.2. isomeria óptica.
Isomeria cis-trans (ou geometrica)
Ocorre em dois casos:
• em compostos com duplas ligações;
• em compostos cíclicos.
Isomeria cis-trans em compostos com duplas ligações
Nos compostos com duplas ligações devermos ter a seguinte
estrutura:
Representando por a, b, c, e d os átomos ou radicais ligados aos
átomos de carbono da dupla ligação:
a) Compostos que não apresentam isômeros geométricos:
b) Compostos que apresentam isômeros geométricos:
“Os isômeros geométricos ou cis-trans de um composto diferem
entre si nas suas constantes físicas (ponto de fusão, ponto de
ebulição, densidade, solubilidade, etc.), e em certas
propriedades químicas.”
Exemplo 1:
O ácido butenodióico cis é chamado ÁCIDO MALÊICO e o trans é chamado
ÁCIDO FUMÁRICO.
Isomeria cis-trans (E-Z)
E→ Trans;
Z→ Cis.
Exemplo2:
(2E)- 2 buteno – 2,3 diamina
(2Z)- 2 buteno – 2,3 diamina
(2E)- 2 buteno – 2,3 diamina
(2Z)- 2 buteno – 2,3 diamina
Isomeria cis-trans em compostos cíclicos
ISOMERIA ÓPTICA
Luz natural e luz polarizada
Luz comum (ou natural);
• É formada por ondas eletromagnéticas, sendo que as elétricas vibram
em um plano e as magnéticas, em outro, perpendicular entre si;
• E a medida que a “luz caminha”, esses dois planos giram em torno de
seu próprio eixo de propagação;
Luz polarizada
• Se pudéssemos enxergar essas vibrações,
teríamos algo parecido com a figura A.
• Na luz polarizada, os planos de vibração
elétrico e magnético não giram, “vendo-a de
frente”, teríamos a figura B;
• Mas é comum representar a luz polarizada
apenas por um dos planos(figura c);
Como polarizar a luz?
• A maneira mais simples é usar o material
denominado “polaróide”;
Substâncias opticamente ativas
• São substâncias que têm atividade óptica;
• Formas geométricas assimétricas;
• Esse tipo de assimetria é chamado de
assimetria quiral (carbonos com quatro ligantes diferentes);
• Logo, a luz polarizada sofre dois desvios um para a direita (dextrogira), e outra
para a esquerda (levogira).
Isomeria Óptica
“A isomeria óptica é um caso particular da isomeria
espacial que só ocorre em moléculas quirais. O termo
quiral se refere a ausência de simetria(assimétrico).”
O termo quiral vem da palavra grega cheir, que significa ‘mão’.
Isomeria óptica com o carbono assimétrico
• Ácido lático dextrogiro, e nós escrevemos ácido d-lático ou
ácido (+) lático;
• Ácido lático levogiro, e nós escrevemos ácido l-lático ou
ácido (-) lático.
Uma molécula quiral não é idêntica a sua imagem
no espelho. As moléculas quirais não possuem plano de
simetria.
Isômeros ópticos
Existem duas classes de isômeros ópticos:
• Enantiômeros = estereoisômeros que são
imagens especulares um do outro, que não se
superpõem.
• Diastereômeros = estereoisômeros que não
são imagens especulares um do outro e que não
se superpõem.
Enantiômeros
• Somente moléculas
enantiômeros.
quirais
podem
apresentar
MISTURA RACÊMICA
É uma mistura contendo 50% de isômero (d) e 50% de
isômero ( l ) do tipo enantiomorfos. A mistura racêmica,
portanto, não desvia o plano de luz polarizada, sendo
opticamente inativa. No entanto, a mistura racêmica
pode ser biologicamente ativa.
Diastereômeros
Cálculo do número de isômeros ópticos e racêmicos
O cálculo do número de isômeros ópticos e racêmicos pode ser
feito utilizando-se as seguintes equações:
• n = Número de carbonos assimétricos;
• 2n = Número de isômeros opticamente ativos (IOA);
• 2n-1 = Número de racêmicos e número de pares de enantiômeros.
Compostos com vários carbonos assimétricos
diferentes
Onde:
• A e B; C e D são enantiômeros;
• A e C; B e C; A e D; B e D são diastereoisômeros (não tem a
imagem especular);
Compostos cíclicos
• Na forma cis é inativo;
• Na forma trans, há isomeria óptica
(transdextrogiro e translevogiro).