Visualização do documento
isomeria 2008 carmo.doc
(5784 KB) Baixar
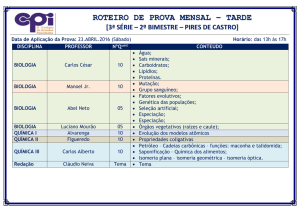
4
ISOMERIA
É a parte da química orgânica, que estuda os compostos de mesma fórmula molecular e
fórmulas estruturais diferentes.
A palavra isômero (iso = mesmo; meros = partes) foi introduzida por Berzelius em 1830.
A isomeria pode ser classificada em isomeria plana e isomeria espacial (estereoisomeria).
ISOMERIA PLANA
É a isomeria em que os isômeros são reconhecidos, identificados e diferenciados pelas suas
fórmulas estruturais planas.
CLASSIFICAÇÃO:
ISOMERIA PLANA DE CADEIA
Aberta / Fechada
Normal / Ramificada
Saturada / Insaturada
Homogênea / Heterogênea
É o tipo de isomeria plana em que compostos de mesma função diferenciam-se no tipo de
cadeia carbônica.
EX.:
ISOMERIA PLANA DE POSIÇÃO
É o tipo de isomeria plana em que compostos de mesma função química e mesma cadeia
principal, irão diferir na posição do grupo funcional, ramificações ou insaturações.
EX.:
ISOMERIA PLANA DE FUNÇÃO
É o tipo de isomeria plana em que compostos de mesma fórmula molecular irão pertencer a
funções diferentes.
EX.:
ISOMERIA PLANA DE COMPENSAÇÃO OU METAMERIA
É o tipo de isomeria plana em que compostos de mesma função química diferem na posição
do heteroátomo.
EX.:
ISOMERIA DINÂMICA OU TAUTOMERIA
É o tipo de isomeria plana em que um ENOL irá transforma-se em aldeído ou cetona e viceversa.
EX.:
ISOMERIA ESPACIAL
É a parte da isomeria em que os isômeros possuem a mesma fórmula estrutural plana e
mesma fórmula molecular a diferença está nas fórmulas estruturais espaciais.
A isomeria espacial é divida em:
Isomeria geométrica
Isomeria óptica
ISOMERIA GEOMÉTRICA
Condição para que exista isomeria geométrica:
O composto seja ser um alceno (composto com dupla ligação) ou um composto cíclico.
Os ligantes de cada átomo de carbono devem ser obrigatoriamente diferentes entre si.
EX.:
TIPOS DE ISÔMEROS GEOMÉTRICOS:
CIS
É um tipo de isômero geométrico em que os ligantes iguais estão no mesmo plano.
TRANS
É o tipo de isômero geométrico em que os ligantes iguais estão em planos opostos.
EX.:
Em compostos cíclicos as regras dos ligantes são as mesmas, observe:
NOMENCLATURA E / Z
A nomenclatura E / Z é usada geralmente para descrever isômeros geométricos em que não
é possível identificar como isômeros CIS ou TRANS.
NOMENCLATURA Z (do alemão Zuzammen, junto)
Os grupos de maior prioridade estão no mesmo lado do plano de referencia.
NOMENCLATURA E (do alemão entgegen, oposto)
Os grupos de maior prioridade estão em lados opostos.
EX.:
ISOMERIA ÓPTICA
O Estudo da isomeria óptica requer inicialmente, que você conheça os conceitos de luz natural
e luz polarizada.
LUZ NATURAL
É aquela formada por ondas eletromagnéticas, vibrando em infinitos planos.
LUZ POLARIZADA
É aquela formada por ondas eletromagnéticas, vibrando em um único plano.
Existem lentes especiais, chamadas de polarizadores; capazes de fazer com que a luz, ao
atravessá-las, sofra o fenômeno da polarização, que consiste em fazê-la passar a vibrar em
um só plano.
Se a luz polarizada atravessar um frasco contendo uma substância cujas moléculas
apresentem isomeria óptica, verifica-se experimentalmente que o plano de vibração da luz
polarizada sofre um desvio, a esse fenômeno dá-se o nome de atividade óptica, onde o
descobridor foi o francês Jean-Baptiste Biot em 1815.
MOLÉCULAS ASSIMÉTRICAS
São aquelas que têm a imagem especular não superponível.
A condição necessária para termos moléculas assimétricas é a presença de um estereocentro,
conhecido vulgarmente como carbono assimétrico ou quiral. Estereocentro (carbono
assimétrico) é aquele que apresenta quatro ligantes diferentes.
Já mencionamos várias vezes a palavra simétrica, veja agora a relação bem estabelecida
entre atividade óptica e simetria. Alguns objetos quando colocados à frente de um espelho
produzem imagens iguais á eles e outros não.
Plano de simetria é um plano que divide duas metades simétricas.
Objetos simétricos
Objetos não simétricos
Tomemos agora moléculas simétricas e não simétricas como exemplo.
Moléculas Simétricas
Moléculas não simétricas (assimétricas)
Uma molécula que não tem simetria é chamada de molécula assimétrica ou quiral. A mesma produzirá uma
imagem especular diferente dela por não apresentar nem um plano de simetria (todos os
ligantes são diferentes). É neste princípio que a isomeria óptica baseia-se.
Condição para que exista isomeria óptica:
Ex.:
TIPOS DE ISÔMEROS ÓPTICOS
DEXTRÓGIRO OU d OU (+)
Desvia o plano da luz polarizada para a direita. O dextrógiro desvia a luz no sentido horário.
LEVÓGIRO OU l OU (-)
Desvia o plano da luz polarizada para a esquerda. O levógiro desvia a luz no sentido antihorário.
Ex.:
CÁLCULO DO NÚMERO DE ISÔMEROS ÓPTICOS
Para compostos com dois ou mais carbonos assimétricos diferentes, é possível saber o número
de isômeros ópticos ativos pela formula:
I = 2N
onde
I= número de isômeros ópticos ativos.
N=número de carbonos assimétricos.
EX.:
A molécula tem 2 carbonos assimétricos, então:
N=2
I=2 I=2 I=4
N
2
Esta moléculas apresenta 4 isômeros ópticos.
MISTURA RACÊMICA OU RACEMATO
É a mistura de quantidades iguais (equimolecular) de dextrógiro e levógiro. A mistura
recâmica É ÓPTICAMENTE INATIVA, por compensação externa, ou seja, o desvio do plano da
luz polarizada será zero. A mistura racêmica é a metade do número de isômeros ópticos
ativos.
Observação
Os isômeros ópticos são chamados de enantiomorfos ou enanciômeros ou antípodas
óprticas, pelo fato de que os enanciômeros (isômeros) diferenciam-se pelas suas formas
(contrarias).
ENANCIÔMEROS
São isômeros onde um é a imagem especular do outro.
DIASTEREOISÔMEROS
São isômeros que não formam imagem especular.
Ex.:
A molécula tem 2 carbonos assimétricos, então:
N=2
I=2 I=2 I=4
Mistura Racêmica = 2
N
2
Esta moléculas apresenta 4 isômeros ópticos. O desenho dos isômeros é feito através da
Projeção de Fischer.
Enanciômero: I e IV, II e III.
Diastereoisômero: I e II, I e III, II e IV, III e IV.
COMPOSTO MESO
É um composto que apresenta carbonos assimétricos e plano de simetria, portanto
apresentará isômeros opticamente ativos e opticamente inativos.
A molécula apresenta dois carbonos assimétricos, portanto 4 isômeros ópticos.
Observe que a molécula II apresenta plano de simetria, portanto não apresenta desvio da
luz, pois haverá anulação do desvio da luz por compensação interna, desta forma o composto
II é um composto meso.
Desistir Nunca
Arquivo da conta:
lendel-hat
Outros arquivos desta pasta:
1 aval 1ano-2 chamada.doc (51 KB)
1 rec 2 ano carmo 2008.doc (77 KB)
1 rec 2 ano carmo 2008.pdf (129 KB)
2 aval 1 ano carmo 2008.pdf (4597 KB)
2 aval 1 ano carmo-RECUPERAÇÃO 2008.doc (63 KB)
Outros arquivos desta conta:
Relatar se os regulamentos foram violados
Página inicial
Contacta-nos
Ajuda
Opções
Termos e condições
Política de privacidade
Reportar abuso
Copyright © 2012 Minhateca.com.br