SEI Ensina - MILITAR
Química
Isomeria
Isomeria
Ocorre quando dois ou mais compostos apresentam a mesma fórmula molecular e diferentes fórmulas estruturais.
Isomeria Plana
É quando os isômeros diferem em sua estrutura plana.
Segundo proposta da IUPAC, podemos resumir o estudo da fenômeno de isomeria conforme o esquema abaixo:
Tipos de Isomeria Constitucional:
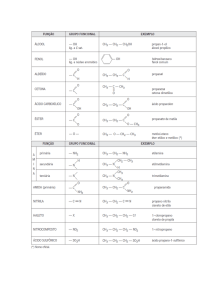
a) Isomeria de cadeia – Os compostos pertencem a uma mesma função química, porém suas estruturas apresentam
cadeias principais diferentes quanto ao número de carbonos ou quanto à forma a cadeia carbônica.
C
H
3
H
C C
H
3
2
C
H
2
C
H
3
e
b
u
tan
o
(n
-b
u
tan
o
)
H
C
2
C
H
3
m
etilp
ro
p
an
o
(iso
b
u
tan
o
)
C
H
3
C
H
H
C C
H
3
e
H
C
2
H
H
C C
2
2
ciclo
p
ro
p
an
o
p
ro
p
en
o
b) Isomeria de posição – Os compostos pertencem a uma mesma função química, apresentam a mesma cadeia
principal, mas são diferentes quanto à posição do grupo funcional ,ou da insaturação ou da ramificação
OH
e
p r o p a n 1 -o l
o u n - p ro p a n o l
OH
p ro p a n -2 -o l
o u is o p ro p a n o l
e
b u t-1 -e n o
b u t-2 -e n o
e
2 -m e tilp e n ta n o
3 -m e tilp e n ta n o
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 1
c) Isomeria de função – Os compostos apresentam diferentes funções químicas.
OH
e
etanol
O
metoximetano
O
e
O
propanona
H
propanal
O
O
e
OH
O
etanoato de
metila
ácido
propanóico
CASOS PARTICULARES DE ISOMERIA CONSTITUCIONAIS NÃO RECONHECIDOS PELA IUPAC:
c) Isomeria de compensação ou metameria – Os compostos pertencem a uma mesma função química, porém
apresentam diferenças na posição do heteroátomo.
e
O
m
eto
x
ip
ro
p
an
o
O
eto
x
ietan
o
e) tautomeria – Se estabelece um equilíbrio químico entre os isômeros.
Tautomeria Aldo-Enólica
O
H
propen-1-ol
O
H
propanal
Tautomeria Ceto-Enólica
O
H
propen-1-ol
O
propanona
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 2
Isomeria Espacial (ou Estereoisomeria)
Nesse caso, além de ocorrer fórmulas moleculares coincidentes entre os isômeros, verificamos que os mesmos também
apresentam a mesma fórmula estrutural. A diferença entre eles ocorrem na fórmula espacial (tridimensional).
a) Isomeria Geométrica – Quando dois átomos de carbono se ligam numa ligação simples, existe uma total liberdade
entre seus núcleos.
O
H
O
H
O
H
H
C H =HC
HC
C
l
l
CC
O
H
C
l
C
l
Porém a ligação dupla não dá esta liberdade gerando o que chamamos de plano de simetria molecular.
R1
R3
C
C
R2
R4
Desta forma, poderemos ter dois compostos espacialmente diferentes se R1≠R2 e R3≠R4
Exemplo : But-2-eno
H
3C
C
H
3
C
C
H
H
cis
H
3C
C
H
C
H
C
H
3
C
H
3
H
3C
C
C
H
H
trans
Este fenômeno pode ser verificando também em compostos cíclicos:
R1
R3
C
C
R2
R4
Exemplo:1,3-dimetilciclopentano
CH3
H3C
C
H
H3C
C
H
cis
CH3
H3C
H
C
C
H
CH3
tran s
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 3
NOMENCLATURA E-Z
b) Isomeria Óptica - Um outro tipo de estereoisomeria é a isomeria óptica. Os isômeros ópticos exibem a propriedade
de interagir com o plano de vibração da luz polarizada, desviando-o de um modo característico e individual.
Luz Polarizada e Atividade Óptica
A luz incandescente é constituídas de ondas de natureza eletromagnéticas. Seu campo elétrico e seu campo magnético
são dispostos de forma perpendicular e se propagam em movimento espiralado.
Existem dispositivos especiais que são capazes de “filtrar” o plano de propagação da luz.Esses dispositivos são
denominados polarizadores.
Neste sentido, podemos classificar a luz em duas categorias:
Luz Natural -Seus raios se propagam em todas as direções.
Luz Polarizada -Seus raios se propagam numa única
direção.
ou
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 4
Obs.:O prisma de Nicol, prisma polarizador, utiliza um cristal transparente de carbonato de cálcio denominado
de espato da Islândia. A preparação do polarizador é feita colando as faces de dois prismas com uma resina
refringente denominada de bálsamo do Canadá.
Desta forma podemos classificar as substâncias nas seguintes categorias:
Amostras Opticamente Ativas.
São capazes de realizar um desvio do plano de polarização da luz, que podem ser dextrógira(d) ou levógira(l).Que
podem ser formadas por substâncias puras ou misturas não equimolares onde predomina uma maior quantidade de um
determinado isômero ativo
Amostras Opticamente Inativas.
São amostras que não são capazes de desviar o plano de polarização da luz. Podem ser formadas por uma mistura
racêmica,mistura equimolar entre os isômeros ópticos ou um composto meso, que sofre uma “compensação interna”
capaz de anular o efeito da passagem da luz polarizada.
ATIVIDADE ÓPTICA E QUIRALIDADE:
Quando comparamos as estruturas de cristais que apresentam experimentalmente atividade óptica, verificamos que
esses cristais são assimétricos,não apresentam plano de simetria. Percebemos que os dois cristais são geometricamente
especulares. Esse fenômeno é observado no cristal de quartzo.
Em 1815 Biot verificou compostos orgânicos naturais eram opticamente ativos em solução aquosa.
Em 1848 Pasteur conseguiu comprovar que determinados produtos inativos do ácido tartárico podiam ser separados de
forma que originou duas amostras ativas, uma dextrógira e outra levógira.
Pasteur então dividiu as amostras em três categorias:
ácido d-tartárico – de comportamento dextrógiro.
ácido l-tartárico – de comportamento levógiro.
ácido tartárico racêmico – amostra original – uma mistura equimolar dos isômeros ativos.
Em 1874 Le Bel e Van't Hoff , dessa forma independente, sugeriram que nos compostos existiria pelo menos um átomo
de carbono tetraédrico responsável pela assimetria molecular(carbono quiral).
A atividade óptica de uma substância está diretamente relacionada com a presença de moléculas assimétricas.
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 5
Resultados apresentados por Le Bel e Van't Hoff para o Ácido Lático( 2-HIDRÓXIPROPANÓICO)
H
H
OH O
C
C
H
H
C
OH
Os enantiomorfos não são coincidentes ou superponíveis.
Ácidos
Ponto de Fusão
o
C
Rotação específica
d-lático
52,8
+2,6o
l-lático
52,8
-2,6o
dl-lático(racêmico)
16,8
0o
Cálculo do Poder Rotatório Específico(funcionamento do polaímetro).
Verificou-se experimentalmente que o ângulo de desvio do plano da luz polarizada depende de 5 fatores para
determinada substância.
da concentração da substância c em g/mL
da espessura da solução l em decímetros(dm).
da natureza da luz
da natureza do solvente
da temperatura
Normalmente , fixam-se três últimas variáveis.
Luz – utiliza-se a luz da lâmpada de sódio correspondente à raia D.
Solvente – de preferência utiliza-se água.Caso o composto seja insolúvel na água pode-se empregar outro
solvente(etanol,éter,benzeno,etc),mas é preciso indicá-lo.
Temperatura – usualmente 20OC.
c . l
onde é o poder rotatório específico.
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 6
Isomeria Óptica com dois átomos de carbonos quirais diferentes
Cada carbono funciona como um centro quiral , e desta forma é possível se obter quatro isômeros ativos, formamos
dois pares de enantiômeros. Se analisarmos pares de isômeros de forma cruzada,percebemos que esses isômeros são
ativos porém com ângulo de desvio da luz polarizada com valores não simétricos,totalmente diferentes. Esses isômeros
são denominados diasterisômeros.
Exemplo:ácido 2-cloro-3-hidroxibutanóico.
O
H
H
O
C
C
C
C
HO
OH
Cl
OH
Se de a e b os ângulos de desvio da luz polarizada de cada centro quiral, podemos afirmar que o polarímetro faria uma
leitura igual a soma algébrica de a e b.
Isômero
1
2
Leitura no
polarímetro
X
+a
+b
+(a+b)
Y
-a
-b
-(a+b)
X'
+a
-b
+(a-b)
Y'
-a
+b
-(a-b)
Forma dl
Forma d'l'
X ,Y, X' e Y' são isômeros ativos:
E
X
Y
D
D
D
D
X'
Y'
E
E
enantiômeros
D
diasteriômeros
Fórmulas de Le Bell e Van't Hoff
Seja n o número de carbonos quirais diferentes num composto. Logo:
isômeros ativos = 2
n
recêmicos = 2 n-1
Exemplo :Glicose
H
H
H
H
H
H
O
C
C
C
C
C
C
OH
OH OH
H
OH OH
Podemos verificar que essa estrutura apresenta 4 átomos de carbono quirais. Logo serão 16 amostras ativas(8
dextrógiras e 8 levógiras) e 8 amostra racêmicos.
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 7
Isomeria com carbonos quirais equivalentes
Nesse caso é possível a existência do composto meso que é inativo pois os centros quirais se cancelam internamente.
Exemplo:Acido Tratárico(2,3 di-hidroxi-butanóico).
O
H
H
O
C
C
C
C
HO
OH
OH OH
Se usarmos o mesmo critério para carbonos quirais diferentes, porém levando-se em consideração que os ângulos
apresentam o mesmo valor temo
Isômero
1
2
Leitura no
polarímetro
Ácido d-tarta´rico
+a
+a
+2ª
Ácido l-tartárico
-a
-a
-2ª
Ácido meso-tartárico
+a
-a
Zero
+2a
-2a
zero
Ácido dl
tartárico(racêmico)
No ácido meso-tartárico os centros quirais são especulares.
Isomeria Óptica sem carbono quiral:
a) Compostos Alênicos: São compostos alênicos aqueles que derivam do propadieno.
R3
R1
C
C
R1
R2 e R3
R4
C
R2
R4
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 8
Exemplo:1,3-dicoloro-propadieno
H
H
C
C
Cl
C
Cl
b) Isômero Trans de Cadeia Cíclica.
Exemplo:trans -1,2-dicloro-cicloexano
Cl
Cl
Cl
Cl
H
H
H
H
Para tentar sobrepor os isômeros, devemos promover num deles uma rotação de 180 o atenção nas projeções das
ligações.
Cl
Cl
H
H
Cl
Cl
H
H
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 9
QUESTÕES
01 – Considere os aldeídos de fórmula molecular Cn-1H2n-1CHO .A opção que mostra o número isômeros de cadeia
que são possíveis quando n = 4 é :
a) 2
b) 3
c) 4
d) 5
e) 6
02 – A equação a seguir ilustra a hidrogenação do álcool insaturado e opticamente ativo A , de massa molar m ,que
fornece um outro álcool B,de massa molar m+2,porém sem atividade óptica.
OH
OH
catalisador
+ H2
R
R
Sendo R um radical alquila, a opção que mostra,respectivamente as nomenclaturas de A e B é:
A
B
a)
Pent-3-en-1-ol
Pentan-3-ol
b)
Pent-1-en-3-ol
Pentan-2-ol
c)
Pent-1-en-3-ol
Pentan-3-ol
d)
Pentan-2-ol
Pent-1-en-3-ol
e)
Pent-1-en-2-ol
Pentan-1-ol
03 – Dada a estrutura abaixo:
NH2
H3C
CH2
C
C
R
OH
O
Para torná-la opticamente ativa, o R deverá ser:
a) –H ou -NH2
b) –CH3 ou –NH2
c) – CH3 ou –CH2CH3
d) –H ou -CH3
e) – CH2CH3 ou –NH2
04 – Considere as afirmações:
I – propanal é isômero da propanona
II – etil-metil-éter é um isômero do propan-2-ol
III – propan-1-ol é um isômero do propan-2-ol
IV – propilamina é um isômero da trimetilamina
Estão corretas:
a) Todas
b) Apenas I ,II e III
c) Apenas I e II
d) Apenas II e IV
e) Apenas III e IV
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 10
05 –(IME) - O éter comum obedece à fórmula geral CnH2n+2O,em que n representa o número de átomos de carbono.
a) Escreva a fórmula e nomenclatura de um éter com quatro átomos de carbono que possua somente carbonos primários
em sua molécula.
b) Escreva as fórmula estruturais dos éteres metâmeros que apresentam quatro átomos de carbono em sua molécula
c) Para n=3, é possível representar três compostos químicos, onde dois deles não são pertencentes à função éter, Escreva
a nomenclatura desses dois compostos.
06 –(UFRRJ) - Sabendo-se que um álcool tem fórmula molecular C4H9OH, pede-se:
a) as fórmulas estruturais dos quatro álcoois isoméricos.
b) a nomenclatura oficial (IUPAC) para cada um deles.
07 – Substitui-se , no n-pentano , um átomo de hidrogênio por um átomo de cloro.
a) Escreva as fórmulas possíveis de serem formados nessa substituição.
b) Escreva a nomenclatura dos compostos que apresenta isomeria óptica.
08 - (IME) - Estabeleça a relação entre as estruturas de cada par abaixo, identificando-as como
enantiômeros,diastereoisômeros, isômeros constitucionais ou representações diferentes de um mesmo composto.
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 11
GABARITO:
01
A
02
E
03
D
04
A
05 a) etoxietano
b)
O
e
O
m
eto
x
ip
ro
p
an
o
eto
x
ietan
o
c)
OH
OH
propan-1-ol
propan-2-ol
06 –
a) e b)
OH
OH
OH
OH
butan-2-ol
butanol
07 –
Cl
metilporpan-1-ol
metilpropan-2-ol
Cl
Cl
1-cloropentano
2-cloropentano
3-cloropentano
b) 2-cloropentano e 3-cloropentano
08 –
a)
O Par
é formado por diastereoisômeros, pois os compostos não são
imagens especulares um do outro.
b)
O par
é formado por enantiômeros, pois estes compostos são um a imagem
especular da outra.
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 12
c)
Os compostos HCOOCH2CH3 e CH3COOCH3 são isômeros constitucionais, pois apresentam diferentes
conectividades.
d)
são diasterisômeros, por que o átomo de carbono que sustém o cloro é
impedido de livre rotação.
e)
o par
é formado por enantiômeros. Reorganizando no espaço temos:
www.seiensina.com.br
Ensino de qualidade 24 horas no ar – www.sistemasei.com.br
Página 13