Ácidos e bases
Química Geral
Prof. Edson Nossol
Uberlândia, 28/09/2016
Acidus: azedo / Alkalis: cinzas de planta
Lavoisier (1776): oxigênio está presente em todos os ácidos
Davy (1810): hidrogênio presente
Arrhenius (1887):
ácido: ioniza produzindo íons H+
base: ioniza produzindo íon OHCondutividade iônica
íons
eletrólito
Limitações da teoria Arrhenius
Água: ótimo solvente → atração eletrostática
H2O
HCl(g) → H+(aq) + Cl-(aq)
Limitações da teoria Arrhenius
Água: ótimo solvente → atração eletrostática
H2O
HCl(g) → H+(aq) + Cl-(aq)
H+ : raio 10-15 m
Raio médio de
átomos ou íons:
10-10 m
Limitações da teoria Arrhenius
Água: ótimo solvente → atração eletrostática
H2O
HCl(g) → H+(aq) + Cl-(aq)
H3O+
Limitações da teoria Arrhenius
Água: ótimo solvente → atração eletrostática
H2O
HCl(g) → H+(aq) + Cl-(aq)
H+(H2O)21
Limitações da teoria Arrhenius
Água: ótimo solvente → atração eletrostática
H2O
HCl(g) → H+(aq) + Cl-(aq)
H3O+
NH3(g) → neutraliza ácidos
Mas onde está o OH-???
Bronsted e Lowry (1923)
Ácido: é um doador de próton
Base: receptor de próton
Força ácidos de Bronsted
Somente pela concentração?
1 mol
L-1
HCl(aq) → 1 mol
L-1
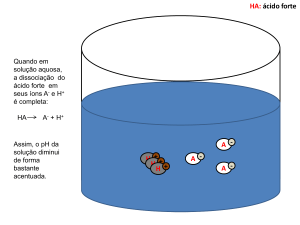
Dissociação total
Ácido forte
H3O+(aq)
1 mol L-1 CH3COOH(aq) → CH3COO-aq) + H3O+(aq)
0,4 % de dissociação
Ácido fraco
+
−
𝑯𝟑𝑶 [𝑪𝑯𝟑𝑪𝑶𝑶 ]
𝑲𝒂 =
= 𝟏𝟎−𝟓
[𝑪𝑯𝟑𝑪𝑶𝑶𝑯]
Força ácidos de Bronsted
+
H 2O
ácido muito
fraco
ácido fraco
ácido forte
HCl → H3O+(aq) + Cl-(aq)
dissociação
ionização
dissociação
parcial
ionização
dissociação
ionização
−
𝑯𝟑𝑶 [𝑪𝒍 ]
𝑲𝒂 =
= 𝟏𝟎𝟔
[𝑯𝑪𝒍]
Quanto mais forte for a base, mais fraco o seu ácido conjugado
Sorensen → Carlsberg
pH = - log [H3O+)
pK = - log K
pKa + pKb= pKw
pKa < 0 ( Ka >> 1 ) = ácido forte
pKa > 0 ( Ka < 1 ) = ácido fraco
3 ton carvão = 1 MW / dia
1 g urânio = 1 MW/ dia
Ácido-base Lewis
Carvão mineral: 1,43% (9 usinas que produzem 1.530.304 KW)
Presença de enxofre
várias reações
SO2(g) → → →
H2SO4 (l)
CaO(s) + SO2(g)→ CaSO3(s)
Reações de precipitação
Química Geral
Prof. Edson Nossol
Uberlândia, 28/09/2016
Formação de um produto pouco solúvel
precipitado
Metástese ou dupla troca
AX + BY
AY + BX
Pb(NO3)2(aq) + 2 KI(aq) -----> 2 KNO3(aq) + PbI2(s)
Formação de um produto pouco solúvel
precipitado
Pb(NO3)2(aq) + 2 KI(aq) -----> 2 KNO3(aq) + PbI2(s)
Precipitado se forma: atração eletrostática entre os íons supera a
tendência dos íons continuarem solvatados!
NO3Ag+
Uma solução contendo
íons prata e nitrato,
quando adiocionada a …
AgI
… um precipitado de
iodeto de prata.
… uma solução
contendo íons
potássio e iodeto
forma …
I-
K+
Qual a equação para
essa reação? (Dica:
quais espécies
realmente reagiram?)
Regras de solubilidade
Regras de solubilidade
CdS
PbS
Ni(OH)2
Al(OH)3
Equações moleculares e equações iônicas
Pb(NO3)2(aq) + 2 KI(aq) -----> 2 KNO3(aq) + PbI2(s)
molecular
Pb2+(aq) + 2NO3-(aq) + 2K+(aq) + 2I-(aq) ---> 2K+(aq) + 2NO3-(aq) + PbI2(s)
iônica
Pb2+(aq) + 2I-(aq) ---> PbI2(s)
iônica simplificada
Exercício: Indique quais são os produtos obtidos e escreva as
equações moleculares, íônicas e iônicas simplificadas para as
seguintes reações em solução aquosa:
(a) sulfato de sódio e nitrato de estrôncio
(b) fosfato de potássio e nitrato de cálcio
(c) perclorato de amônio e brometo de sódio