4/3/2010
Disciplina: Química Analítica Qualitativa
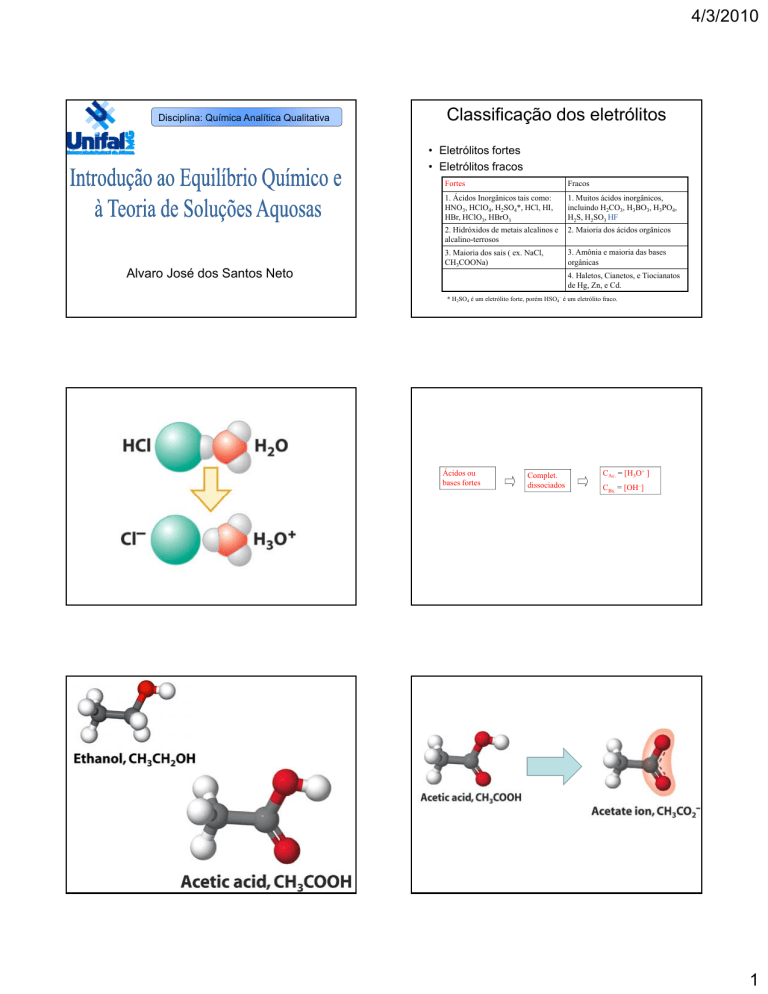
Classificação dos eletrólitos
• Eletrólitos fortes
• Eletrólitos fracos
Fortes
Fracos
1. Ácidos Inorgânicos tais como:
HNO3, HClO4, H2SO4*, HCl,
HCl HI,
HI
HBr, HClO3, HBrO3
1. Muitos ácidos inorgânicos,
incluindo H2CO3, H3BO3, H3PO4,
H2S, H2SO3 HF
2. Hidróxidos de metais alcalinos e
alcalino-terrosos
2. Maioria dos ácidos orgânicos
3. Maioria dos sais ( ex. NaCl,
CH3COONa)
3. Amônia e maioria das bases
orgânicas
Alvaro José dos Santos Neto
4. Haletos, Cianetos, e Tiocianatos
de Hg, Zn, e Cd.
* H2SO4 é um eletrólito forte, porém HSO4– é um eletrólito fraco.
Ácidos ou
bases fortes
Complet.
dissociados
CAc. = [H3O+ ]
CBs. = [OH–]
1
4/3/2010
Como demonstrar a presença de
um eletrólito forte?
Teoria de ácidos e bases
1) Definição de Arrhenius
2) Definição de Brönsted-Lowry – Conceito prótico
Ácido = gera H3O+ quando acicionado à água
Ácido = doador de prótons
HA + H2O = A– + H3O+
Base = aceptor de prótons
Base = produz íons OH– em solução aquosa
B + H2O =
BH+
+
HA + H2O = A- + H3O+
B + H2O = BH+ + OH–
OH–
Pares ácido-base conjugados:
Svante Arrhenius
(1859-1927),
Químico Sueco.
A1 + B2 = B1 + A2
Ex.
HCl + H2O =
Cl– + H3O+
NH3 + H2O =
NH4+ + OH–
CH3COOH + CH3NH2 = CH3COO– + CH3NH3+
água = substância anfiprótica
2
4/3/2010
3) Conceito de pares de elétrons ( Definição de Lewis)
Ácido = aceptor de par de elétrons
Base = doador de par de elétrons
Ex. 1) H3O + + :OH– = H2O + H:OH
2) BCl3 + :NH3 = Cl3B:NH3
3) em solventes não aquosos:
–
–
SbCl5 + :Cl = [SbCl6]
Equilíbrio em uma reação
Exemplo – Produção ou decomposição da amônia
3
4/3/2010
A Lei do Equilíbrio
aA + bB
Constante
de equilíbrio
K=
[C]c[D]d
[A]a[B]b
cC + dD
Quando K é >1 a reação é favorecida
“Lei da ação das massas”
• Exemplos:
– Ácidos fracos
– Dissolução de um precipitado
– Reação redox
– Reação de complexação
Cato Guldenberg (1836-1902) e Peter Waage (1833-1900) – Químicos Noruegueses
Interpretação cinética do equilíbrio
Exemplo
A e B desaparecendo
• H2O
+
⇒ KW
• NH3 + H2O
NH4+ + OH- ⇒ KNH =1,8x10-5
H+
OH-
=1,0x10-14
Concentração de
3
Equilíbrio
• Calcular K para NH4+
C e D aparecendo
0
Estágio
Inicial
Tempo
Mudança
Equilíbrio
Progresso da reação química: A+B ⇒ C+D
Interpretação termodinâmica do equilíbrio
- O correto seria calcular a constante de equilíbrio em
termos de atividade (a) e não em concentração.
• Importante ao calcular a constante de equilíbrio:
– Concentração dos solutos é expressa em mol/L
– Pressão dos g
gases em bar
– Concentração para sólidos ou líquidos puros e
solventes é igual a 1.
• Reação no sentido oposto:
– K’ = 1/K
• Duas reações são somadas:
– K3 = K1xK2
Equilíbrio e Termodinâmica
O calor absorvido (entalpia) ou desprendido pela reação e o grau de desordem
dos reagentes e produtos (entropia) contribuem independentemente para
favorecer ou desfavorecer a reação.
ΔH<0 – exotérmica
ΔH>0 – endotérmica
• Entropia (S)
ΔS>0 – + desordenado
ΔS<0 – - desordenado
Reação é favorecida por ΔH<0 e/ou ΔS>0.
ΔG = ΔH - T ΔS
¾Se ΔG<0 – reação espontânea
¾Se ΔG>0 – reação não-espontânea
• Entalpia (H)
4
4/3/2010
Relação entre ΔG e K
Ex.
K=
+
HCl = H + Cl
–
0
e-ΔG/RT
ΔG = ΔH –TΔS
o
o
o
3
= (–75.15×10 J) – (273.15+25K)(–131.5J/K)
= – 35.94 kJ/mol
Significado:
- Se ΔG0<0 ,
∴K=e
K>1
–(–35.94×1000J/mol)/[8.31441 J/(Kmol)](298.15K)
= 1.98 ×10
6
Princípio de LeChâtelier
R↔P
Quociente de reação :
se
Q = [P] / [R] ≠ K
Q = K ⇒ equilíbrio
Q < K ⇒ reação p/ direita, espontânea
Q > K ⇒ reação p/ esquerda, não-espontânea
Endothermic reaction : T↑ ⇒ K↑
Exothermic reaction :
T↑ ⇒ K↓
calor + reagentes ↔ produtos (ENDO)
reagentes ↔ produtos + calor (EXO)
5
4/3/2010
Fatores que afetam K
Fatores que afetam K
6
4/3/2010
Equilíbrios importantes na análise química
Produto de solubilidade
Exemplo: Hg2Cl2 ↔Hg22+ + 2ClKPS=[Hg22+][Cl-]2
Efeito do Íon Comum
7












