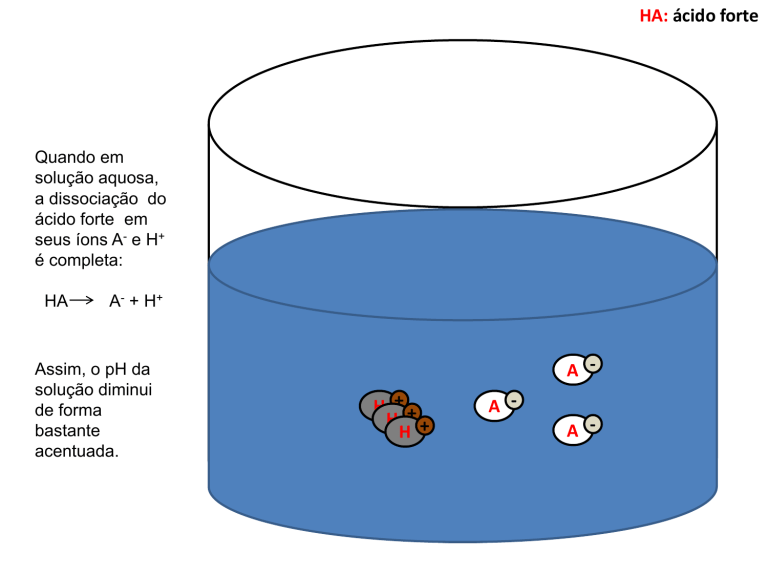
HA: ácido forte
Quando em
solução aquosa,
a dissociação do
ácido forte em
seus íons A- e H+
é completa:
HA
A - + H+
Assim, o pH da
solução diminui
de forma
bastante
acentuada.
HA
HA
A -
HA
H ++
H +
H
A -
A -
HA: ácido fraco
Os ácidos fracos têm a
baixa taxa de dissociação
como uma de suas
principais características.
Assim,quando em
solução aquosa, a
dissociação do ácido
fraco em seus íons A- e
H+ não é completa. Além
disso, as formas
conjugadas e os íons
estão em equilíbrio
químico, regido por uma
constante de dissociação
(Ka) e a reação química
ocorre em ambos os
sentidos:
HA ↔ A- + H+
Portanto, o pH da
solução diminui, porém
esta diminuição é muito
discreta. E, ainda, no
caso de adição de mais
H+ à solução, este tende
a se ligar a base
conjugada do ácido
fraco, evitando grandes
variações de pH na
solução.
HA
+
H
A
HA
HA












