Funções Inorgânicas
Professor :Bruno Santana Lima
Funções Químicas
Função Química é o conjunto de substâncias
com propriedades químicas semelhantes,
denominadas PROPRIEDADES FUNCIONAIS.
As principais funções inorgânicas são: ácidos,
bases, sais e óxidos.
1.Teoria de Brönsted-Lowry:(Teoria Protônica)
Ácido: Espécie (íon ou moléc.) doar um próton H+
+
Base: Espécie (íon ou moléc.) receber um próton H
H+
Gilbert Lewis
Teoria Eletrônica
Ácido: Espécie (íon ou moléc.) receber um par de e.
Base: Espécie (íon ou moléc.) doar um par de e.
Gravar:
Ácido:
Base:
1. cátion
1. ânion
2. Subst. c/ EC* c/
2. Subst. c/ EC* s/
Pares de elétrons
Pares de elétrons
livres.
livres.
3. C = O
3. C = C
EC* Elemento Central
Fe(CN)6-3
H
N
H
Base
H
Base
NH4+
F
Ácido
F
B
F
Ácido
O
CH3- CH = CH2
CH3- CH2 – C – H
Ácido
Base
Cl
Cl
PCl5
Cl
P
Ácido
Cl
Cl
Base
PCl3
P
Cl
Cl
Cl
Teoria Ácido-Base de Arrhenius
Teoria da dissociação eletrolítica
de Arrhenius
• Teoria da dissociação eletrolítica de
Arrhenius - Quando uma substância dissolvese em água, vai-se dividindo em partículas
cada vez menores.Em alguns casos, essa
divisão pára nas moléculas e a solução não
conduz a corrente elétrica.
• Em outros casos, a divisão vai além de
moléculas; estas dividem-se em partículas
ainda
menores,
com
carga
elétrica,
denominadas íons. Nestes casos, a solução
conduz a corrente elétrica.
Continuação ........
• Dissociação iônica é a separação dos
íons de uma substância iônica, quando ela
se dissolve na água.
Ionização é a formação de íons na reação
de uma substância molecular com a água,
quando esta substância molecular nela se
dissolve.
Eletrólitos: Conduzem a corrente elétrica
Não Eletrólitos: Não conduzem a corrente elétrica
Ñ eletrólito
H2O
Eletrólito
H2O
Condutividade das substâncias
Condutividade elétrica de substâncias puras (100%)
Composto iônico: conduz somente quando fundido.
Composto molecular: não conduz em nenhum estado
físico.
Condutividade elétrica em solução aquosa
Composto iônico: conduz.
Composto molecular: conduz ou não, dependendo do fato
de haver ou não reação de ionização entre o composto
dissolvido e a água.
Svante August Arrhenius (1859-1927),
químico e físico sueco, desenvolveu a
teoria da dissociação iônica. Segundo essa
teoria, o íon de hidrogênio H+, que na
presença de água forma o cátion hidrônio
(H3O+), é responsável pelas propriedades
ácidas; enquanto o ânion hidroxila (OH-),
pelas propriedades básicas.
HCl(aq) H+(aq) + Cl-(aq)
NaOH(aq) Na+(aq) + OH-(aq)
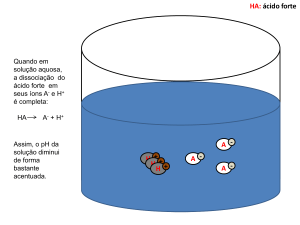
Os ácidos são substâncias moleculares,
sendo assim, o processo da liberação de
íons H+ ocorre por ionização. Ou seja, há
rompimento de ligações covalentes com
formação de íons.
As bases são, geralmente, substâncias
iônicas; portanto, o processo de liberação
de íons OH- ocorre por dissociação
iônica.
Conceito de ácido de Arrhenius
• Conceito de ácido de Arrhenius Substância, em solução aquosa, que
libera como cátions somente íons H+.
• Conceito atualizado de ácido de
Arrhenius - Substância, em solução
aquosa, que libera como cátions somente
íons H3O+ (íons hidrônio ou hidroxônio).
Representação eletrônica de Lewis
do íon hidrônio
Classificação dos ácidos
monoácidos: na ionização libera apenas
1H+ . Exemplo: HCN, HCl, HNO3, etc.
diácidos: na ionização libera 2H+ . Exemplo:
H2SO4, H2CO3, etc.
triácidos: libera 3H+: H3PO4, H3BO3, etc
tetrácidos: libera 4H+: H4P2O7, H4SiO4, etc
Os ácidos com 2 ou mais hidrogênios
ionizáveis são denominados poliácidos.
• Hidrácidos: não contêm oxigênio: HCl, HBr,
H2S, etc;
• Oxiácidos: contêm oxigênio: HNO3, H2SO4,
e H3PO4, etc.
Nomenclatura dos ácidos
Hidrácidos
Ácido (nome do elemento) + ídrico
Exemplos:
HCl – ácido clorídrico
HBr –
HI –
HF –
H2S HCN -
Oxiácidos:
Ácido (nome do elemento) + ico
Adotando como padrão os cinco ácidos
abaixo:
HClO3 – Ácido clórico
H2SO4 – Ácido sulfúrico
HNO3 – Ácido nítrico
H3PO4 – Ácido fosfórico
H2CO3 – Ácido carbônico
Variando o n° de oxigênio desses ácidos,
obteremos outros cujos nomes são
formados pela união de sufixos e prefixos: