QUÍMICA – 3ºCOLEGIAL – 1303
Ácidos – toda substância que, em água, sofre ionização originando como cátions apenas
H+ ou H3O+.
Exemplo:
Ionização - HCl + H2O → H3O+ + ClDissociação iônica - NaCl + H2O → Na+ + ClIonização: é a reação entre uma substância molecular e água, cujo produtos são íons.
Dissociação iônica: é a separação dos íons de uma substância iônica quando
dissolvidos em água.
Uma condição para o hidrogênio ser ionizável é estar ligado a um átomo bastante
eletronegativo – F O N Cl Br I S C P .
- soluções eletrolíticas – conduz corrente elétrica.
- eletrólitos – composto que em solução aquosa conduz corrente elétrica.
Bases – toda substância que, em água sofre dissociação, produzindo como ânions íons
OH- (hidroxila).
Exemplos:
NaOH → Na+ + OHDissociação: é a separação de íons positivo
Ca(OH)2 → Ca2+ + 2OH(cátion) e negativos (ânions) de uma substância
em água.
Força dos Ácidos, Bases e Sais
O valor numérico do grau de ionização (α) de um ácido é dado pela relação:
α = número de moléculas ionizadas
número de moléculas dissolvidas
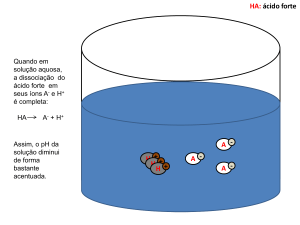
CLASSIFICAÇÃO DOS ÁCIDOS PELA SUA FORÇA (α)
Ácidos fortes: α > 50%
Ácidos semifortes: 50% < α > 5%
Ácidos fracos: α < 5%
Exemplos:
HCl: a cada 100 moléculas dissolvidas em água, 92 se ionizam.
α = 92 = 0,92 ou 92% de moléculas ionizadas (ácido forte)
100
Regra prática para verificar se um ácido oxigenado é forte, fraco ou semiforte.
HxEOy
Devemos subtrair o número de hidrogênios do número de oxigênios, os resultados
segue:
(y – x) ≥ 2 forte
(y – x) = 1 semiforte
(y – x) = 0 fraco
Exemplos: HClO4 = 4 – 1 = 3 ácido forte
H2SO4 = 4 – 2 = 2 ácido forte
H3PO4 = 4 – 3 = 1 ácido semiforte
H3BO3 = 3 – 3 = 0 ácido fraco
Para os ácidos não oxigenados não existe uma regra, ao mais usados são:
Ácidos fortes: HCl, HBr e HI
Ácido semiforte: HF
Ácidos fracos: H2S, HCN
FORÇA DAS BASES
Os hidróxidos dos metais alcalinos e alcalinos terrosos são compostos iônicos solúveis
na água e, por isso, são bases fortes (têm elevado grau de dissociação).
Os hidróxidos dos metais não alcalinos e não alcalinos terrosos são insolúveis na água e,
por isso, constituem bases fracas (baixo grau de dissociação).
FORÇA DOS SAIS
Os sais são compostos iônicos. Por isso os sais solúveis na água constituem eletrólitos
fortes.
Neutralização Total ou Neutralização ácido – base ou Reação de Salificação
Ácido + Base → Sal + Água
HCl
NaOH NaCl H2O
TEORIA PROTÔNICA
Exemplos:
De a acordo com a reação a substância altera seu caráter:
-
+
H2SO4 + H2O ↔ HSO4 + H3O
A
B
B
A
-
2-
+
HSO4 + H2O ↔ SO4 + H3O
A
B
B
A
Água com caráter ácido:
+
NH3 + H2O ↔ NH4 + OH
-
B A
A
B
Força dos pares conjugados:
-
+
HCN + H2O ↔ CN + H3O
A
B
B
A
HIDRÓLISE SALINA
Definição
Hidrólise salina é o processo em que íons provenientes de um sal reagem com a água,
ou seja, quando um sal BA é jogado em água, pode ocorrer uma reação chamada hidrólise, que
é o inverso de uma reação de neutralização.
Sal + água → Ácido + Base
Uma solução salina pode originar soluções ácidas e básicas. Os sais presentes se
dissociam em cátions e ânions, e dependendo destes íons a solução assume diferentes valores de
pH.