ENFERMEIRA
SCHEILA CRISTINA DE MERCEDES
• Segundo a Teoria de Arrhenius, os ácidos
são as substâncias que liberam íons H+
em solução aquosa. Um ácido forte seria
aquele que mais liberasse estes íons.
• Observe a ionização e dissociação do
ácido clorídrico em água:
• As duas setas que indicam os sentidos
das reações (já que toda reação é, mesmo
que irrisoriamente, reversível) foram
propositalmente postas em dimensões
diferentes para mostrar que a dissociação
dos íons ocorre com maior frequência do
que a formação de HCl molecular. Assim,
se considerarmos a dissociação completa,
não haverá mais HCl em solução, mas os
íons H+ e Cl-.
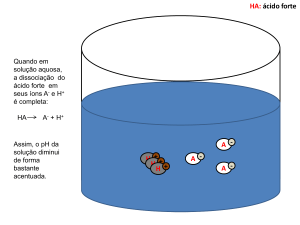
• Assim, ácidos cuja reversibilidade de
dissociação é muito baixa (dissociação
próxima de 100%), são classificados
como fortes. Logo, para cada 1mol de
ácido forte monoprótico (com 1 átomo de
hidrogênio em cada molécula) em
solução, tendem a se formar 1 mol de
íons de hidrogênio e 1 mol de ânions
(para o ácido clorídrico, Cl-).
• O grau de ionização de um ácido
(α) determina a quantidade de
cátions e ânions que serão
produzidos a partir de
determinada quantidade de ácido
molecular. Assim, quanto mais
íons forem produzidos mais
próximo α estará de 1.
•
•
•
•
•
Ácido Hidroiodico - HI (pKa = −9.3)
Ácido Hidrobromico - HBr (pKa = −8.7)
Acido perclórico - HClO4 (pKa ≈ −8)
Ácido clorídrico - HCl (pKa = −6.3)
Ácido sulfúrico - H2SO4 (apenas a primeira
dissociação, pKa1 ≈ −3)
• Ácido p-tolueno-sulfonico – CH3C6H4SO3H
(pKa = −2.8) – é o ácido orgânico mais forte
conhecido.
• http://www.infoescola.com/quimica/acidos-fortes/