Metabolismo e Endocrinologia
Grupo 1
12 de Abril de 2006
Inter relação do ponto isoeléctrico,
pH da solução e carga eléctrica de determinados aminoácidos
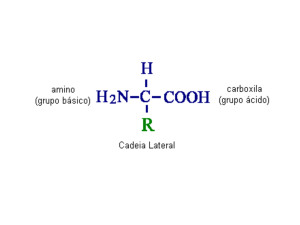
Classificação dos Aminoácidos
É o radical "R" quem define uma série de características dos AA, tais como polaridade e
grau de ionização em solução aquosa. É a polaridade do radical "R" que permite a classificação
dos aminoácidos em 3 classes:
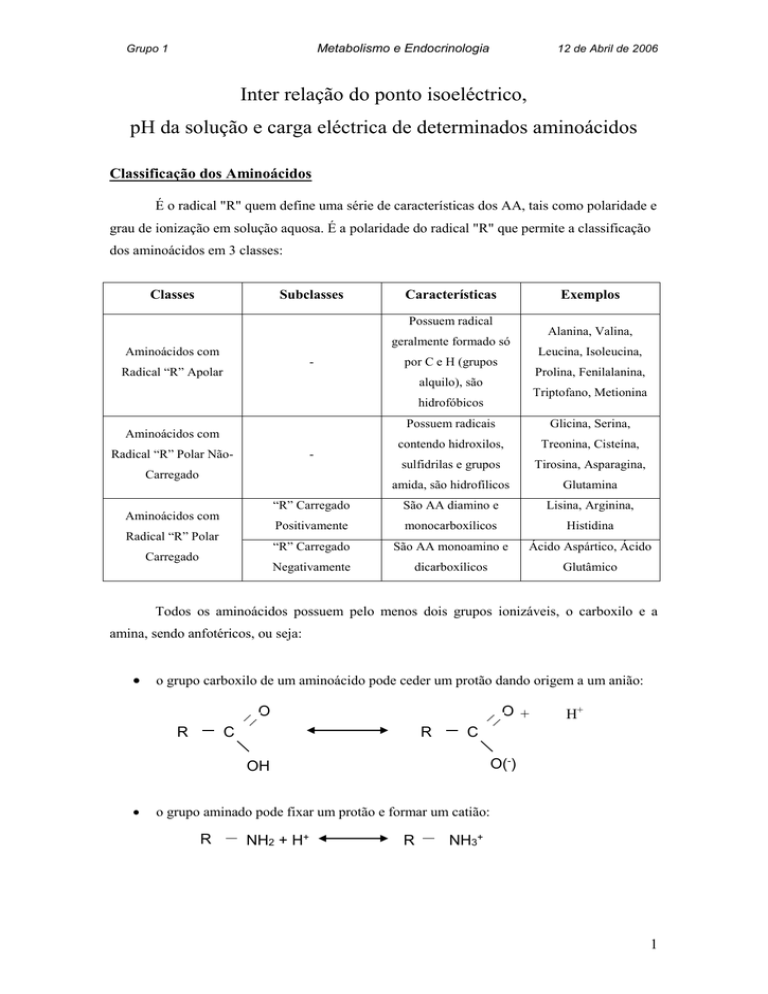
Classes
Subclasses
Características
Exemplos
Possuem radical
Alanina, Valina,
geralmente formado só
Aminoácidos com
-
Radical “R” Apolar
Leucina, Isoleucina,
por C e H (grupos
Prolina, Fenilalanina,
alquilo), são
Triptofano, Metionina
hidrofóbicos
Possuem radicais
Glicina, Serina,
contendo hidroxilos,
Treonina, Cisteína,
sulfidrilas e grupos
Tirosina, Asparagina,
amida, são hidrofílicos
Glutamina
“R” Carregado
São AA diamino e
Lisina, Arginina,
Positivamente
monocarboxílicos
Histidina
“R” Carregado
São AA monoamino e
Ácido Aspártico, Ácido
Negativamente
dicarboxílicos
Glutâmico
Aminoácidos com
Radical “R” Polar Não-
-
Carregado
Aminoácidos com
Radical “R” Polar
Carregado
Todos os aminoácidos possuem pelo menos dois grupos ionizáveis, o carboxilo e a
amina, sendo anfotéricos, ou seja:
o grupo carboxilo de um aminoácido pode ceder um protão dando origem a um anião:
O
R
O +
C
R
C
O(-)
OH
H+
o grupo aminado pode fixar um protão e formar um catião:
R
NH2 + H+
R
NH3+
1
Metabolismo e Endocrinologia
Grupo 1
12 de Abril de 2006
Quando se faz passar uma solução de um aminoácido de um pH baixo a um pH elevado,
ocorrem as seguintes transformações:
-H+
+H N
3
CH
-H+
+H N
3
COOH
+H+
R
COO-
CH
H2N
+H+
R
CH
COO-
R
catião (a pH ácido)
zwitterion
anião (a pH alcalino)
carga bruta = + 1
carga bruta = 0
carga bruta = - 1
Verifica-se que se passa por um valor de pH a que as moléculas de aminoácido se
apresentam todas sob a forma dipolar (também chamada zwitterion) na qual a carga da molécula
é nula. É o ponto isoeléctrico (pI) do aminoácido.
(pI) = (pKi+pKj)
2
Ki e Kj - constantes de dissociação das
ionizações envolvendo a espécie neutra
A este valor de pH, a solubilidade é mínima e o aminoácido não migra quando colocado
num campo eléctrico (contrariamente ao catião e ao anião).
Pode facilmente estudar-se a dissociação das diferentes funções polares de um
aminoácido, adicionando à solução HCl ou NaOH e medindo o pH após cada adição. Podem,
assim, traçar-se as curvas de titulação, cuja forma será diferente conforme se trate de um
aminoácido neutro, ácido ou básico.
Titulação de um aminoácido neutro
Quando se adiciona ácido (HCl), titula-se a base R-COO- :
+
H3N – CH2 – COO- + H+ Cl-
Cl- +H3N - CH2 –COOH
Quando se adiciona base (NaOH) titula-se o ácido fraco R - NH3+ :
+
H3N – CH2 – COO- + Na+ OH-
H2N - CH2 –COO- Na+ + H2O
Verifica-se no gráfico que existem duas
zonas em que a adição de HCl ou de NaOH produz
apenas uma pequena variação do valor de pH. Existe
portanto um efeito tampão e, efectivamente, a
glicina é utilizada na composição de um tampão
glicina – HCl e um tampão glicina - NaOH. No meio
de cada uma destas zonas tampão temos um valor de
pH correspondente ao pK dos dois grupos; pK1
(meia dissociação do carboxilo) = 2,3 e pK2 (meia
dissociação de amina) = 9,7.
2
Grupo 1
Metabolismo e Endocrinologia
12 de Abril de 2006
O pH isoeléctrico é então dado por:
pI = pK1 + pK2 =
2
2.3 + 9.7 = 6
2
Como se pode ver pela figura, este valor de pI situa-se ao centro de uma zona
isoeléctrica.
Titulação de um aminoácido ácido
Comportamento do ácido aspártico em função do pH :
Se a solução for fortemente ácida, teremos o
ácido aspártico inteiramente sob a forma protonada;
ao adicionarmos soda, esta vai reagir com todos os
protões que o aminoácido pode fornecer. Os pk
correspondentes às semidissociações dos 3 protões
são respectivamente 2,1 , 3,9 e 9,8.
Diferentes formas obtidas por adição de NaOH a uma solução ácida de ácido aspártico:
A pH 2.1 teremos em quantidades iguais as formas de carga bruta +1 e 0.
A pH 3.9 teremos em quantidades iguais as formas de carga 0 e -1.
A forma de carga 0 será predominante a pH 2,9 (pH isoeléctrico do ácido aspártico).
3
Grupo 1
Metabolismo e Endocrinologia
12 de Abril de 2006
Titulação de um aminoácido básico
Comportamento da lisina em função do pH:
Face ao que foi visto, se tivermos, por exemplo, uma mistura de aminoácidos numa solução
a pH 6:
Os AA neutros como a glicina estarão sob a forma de ião dipolar +A- (carga = 0);
Os AA ácidos como o ácido aspártico estarão sob a forma +A-2 (carga = -1);
Os AA básicos como a lisina estarão sob a forma 2+A- (carga = +1).
Bibliografia
D.L. Nelson, M. M. Cox, “Lehninger Principles of Biochemistry” (4th edition), Freeman, New
York, 2005;
J. H. Weil, “Bioquímica Geral” (2ª edição), Fundação Calouste Gulbenkian, Lisboa, 2000.
http://www.ccet.ufrn.br/~duarte/propriedades_acido_base_AA.htm
http://turma2000.1.vilabol.uol.com.br/aminoacidos.htm
4