ENZIMAS
ENZIMAS
São catalisadores biológicos→ aceleram a velocidade das
reações, sem alterar a proporção entre reagente e
produtos encontrada no final da reação e sem serem
consumidos durante o processo.
A maioria das enzimas são proteínas
Exceção: RNAs que tem ação
enzimática (ribozima)
A manutenção da vida celular depende de um conjunto de
reações químicas que devem ocorrer com alta
especificidade e a velocidades adequadas.
Enzimas
Estrutura
Enzimática
Ribozimas
RNAs
Proteínas
Conjugadas
Cofator + apoenzima
Holoenzima
Simples
Apoenzima
Enzimas - Nomenclatura
No século XIX - poucas enzimas identificadas
•
Adicionava-se sufixo ASE ao nome do substrato
– enzima que hidrolisam
• gorduras (lipo - grego) - LIPASE
• amido (amylon - grego) - AMILASE
• proteínas - PROTEASE
•
• Nomes arbitrários
• Tripsina e pepsina - proteases
• Catalase - H2O2
Enzimas - Nomenclatura
• Sistema Oficial IUB (União Internacional de Bioquímica)
• Cada enzima - no de código (E.C.- Enzime Comission) com
4 dígitos que caracterizam o tipo de reação
•1o
•2o
dígito - classe
dígito - subclasse
•3o dígito - sub-subclasse
•4odígito - indica o substrato
Enzimas - Classificação
N0
Classe
Tipo de reação catalisada
1 Oxirredutases Transferência de elétrons
(íons hidreto ou átomos H)
2 Transferases Reações de transferência de grupos
3 Hidrolases
Reações de hidrólise
4 Liases
Adição de grupos em ligações duplas ou
remoção de grupos com a formação de
ligações duplas
5 Isomerases
Transferência de grupos dentro da mesma
molécula para formar isômeros
6 Ligases
Formação de ligações C-C, C-S, C-O, C-N
pelo acoplamento da clivagem do ATP
Enzimas - Classificação
1.AH
Oxirredutases
– transferência de elétrons
+ B
A + BH
2
2
Exemplo Ácido
Lático
Desidrogenase
Lactato
desidrogenase
COOH
CO
CH3
NADH
Ácido Pirúvico
NADox
COOH
H-C- OH
CH3
Ácido Lático
Enzimas - Classificação
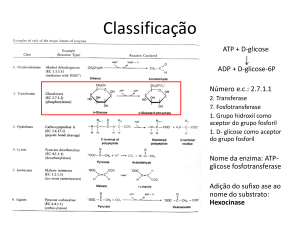
2. Transferases
transferência de grupos
Exemplo: Hexoquinase
Enzimas - Classificação
3. Hidrolases - reações de hidrólise (quebra)
Exemplo: Lactase
Lactose
(-D-glicopironosil--Dgalactopiranose )
H2O
Glicose + Galactose
Enzimas - Classificação
4. Liases –
adição ou remoção
de grupos (H2O,
NH4+, CO2).
Ex: Fumarase
Enzimas - Classificação
5. Isomerase – transferência de grupos dentro da mesma
molécula, formação de isômeros
Triose Phosphate
Isomerase
Enzimas - Classificação
6. Ligases – reações de síntese com consumo de ATP
Exemplo: Piruvato carboxilase
Resumo das 6 classes
Enzimas - Nomenclatura
ATP + D-Glicose
ADP + D-Glicose-6-fosfato
IUB - ATP:glicose fosfotransferase
E.C. 2.7.1.1
2 - classe - transferase
7 - sub-classe - fosfotransferase
1 - sub-subclasse - fosfotransferase que utiliza grupo
hidroxila como receptor
1 - indica ser a D-glicose o aceptor do grupo fosfato
Hexoquinase
Como as enzimas trabalham?
• A enzima possui uma cavidade denominada centro
ativo ou sítio catalítico.
• Região na qual o substrato se liga.
• Formados por aminoácidos trazidos à proximidade uns
dos outros pelos dobramentos da cadeia polipeptídica.
• Permite o reconhecimento do substrato.
• O substrato deve ter a forma espacial adequada para
alojar-se no centro ativo e grupos químicos capazes de
estabelecer ligações precisas com os radicais do
centro ativo.
Enzimas
Centro Catalítico / Sítio Ativo
•Região da molécula enzimática que
participa da reação com o substrato
•Pode possuir componentes
não protéicos
• cofatores
•Possui aminoácidos
auxiliares e de contato
Enzimas
Catalisadores
Aumentam a velocidade das reações
Atuam diminuindo a energia de ativação
Enzimas
Componentes da Reação Enzimática
E+S
ES
E+P
E - Enzima
S - Substrato(s)
ES - Complexo Enzima -Substrato
P – Produto(s)
Enzimas
Componentes da Reação Enzimática
E+S
ES
Substrato se liga ao
SÍTIO ATIVO
da enzima
P+E
Enzimas
• Energia de ativação
– Diferença entre os níveis de energia do estado
basal e do estado de transição
Energia de ativação sem enzima
Diferença entre
a energia livre
de S e P
S
Energia de ativação com enzima
P
Caminho da Reação
Enzimas
Ligação da Enzima ao Substrato
Reação imaginária:
Sem catálise enzimática esta reação não ocorreria, pois a energia
de ativação a ser transposta é muito alta.
Modelo chave-fechadura
Neste modelo o complexo ES seria muito estável, impedindo a
transformação do substrato em produto. A catálise não ocorreria.
Modelo do encaixe induzido
Uma enzima complementar ao estado de transição
da reação ajudará a desestabilizar o bastão,
resultando em catálise da reação. As interações
entre substrato e enzima fornecem a energia que
compensa o aumento de energia livre necessária
para dobrar o bastão.
Modelo do encaixe induzido
Encaixe induzido: enzima e o substrato sofrem conformação para o
encaixe. O substrato é distorcido para conformação exata do estado
de transição.
Sítio ativo
Inúmeras interações fracas entre enzimas e substratos
são formadas (pontes de hidrogênio, interações
hidrofóbicas, pontes iônicas)
A energia livre liberada pela formação destas interações
parcialmente supre a energia para atingir o topo da colina
energética.
Esta mesma energia de ligação faz com que a enzima seja
específica