QBQ 0204 – Bioquímica
Proteínas: estrutura e função
Carlos Hotta
25/03/17
Previously...
•
•
•
•
Aminoácidos são compostos por um grupo amina (-NH3+/-NH2), um grupo carboxila
(-COOH/-COO-), e um radical
As propriedades de um aminoácido dependem de seu radical
Aminoácidos podem ser carregados dependendo do pH do meio
Utilizamos 20 aminoácidos em nossas proteínas
A estrutura dos aminoácidos
Proteínas são polímeros de aminoácidos
•
•
•
Os aminoácidos se ligam entre si por ligações peptídicas
As ligações peptídicas são planares, mas um pouco de flexibilidade é necessária
Grupos radicais podem ser fosforilados, glicosilados, hidroxilados e carboxilados,
etc.
Tipos e funções de proteínas
Enzimas – catalisam reações bioquímicas
Proteínas estruturais – formam estruturas biológicas
Transportadores – carregam substâncias bioquimicamente importantes
Proteínas de defesa – defendem o corpo
contra invasores
Estrutura de proteínas
•
Estrutura primária: sequência de
aminoácidos de forma linear
•
Estrutura secundária: estruturas locais
dentro da proteína
•
Estrutura terciária: estruturas
tridimensional global da proteína
•
Estrutura quaternária: estruturas
complexas que envolvem múltiplas
unidades
•
As proteínas possuem estruturas
flexíveis
Interações que determinam a estrutura de proteínas
•
ligações de hidrogênio
•
Interações hidrofóbicas
•
ligações iônicas
•
ligações dissulfeto
Estrutura secundária de proteínas
•
•
•
Porções das proteínas se organizam em estruturas regulares
As estruturas secundárias são mantidas por ligações de hidrogênio e interações
hidrofóbicas
As estruturas mais comum são as α-hélices e as folhas-β
Estrutura secundária de proteínas: α-hélices
•
•
•
Radicais grandes demais ou pequenos demais
podem desestabilizar as hélices
Ligações de hidrogênio são formadas a cada 4
aminoácidos
Uma volta é dada a cada 3.6 aminoácidos
Estrutura secundária de proteínas: folhas-β
barril
•
•
•
Organizam-se em folhas paralelas ou antiparalelas
Os radicais dos aminoácidos ficam em outro
plano
Podem se organizar em domínios maiores
Estruturas super-secundárias
•
As estruturas secundárias podems
e organizar em super-estruturas
conhecidas
Estrutura terciária de proteínas
•
•
•
Praticamente impossível de prever a estrutura terciária
Estrutura primária pode ser utilizada para prever função
Estruturas conhecidas podem ajudar na predição
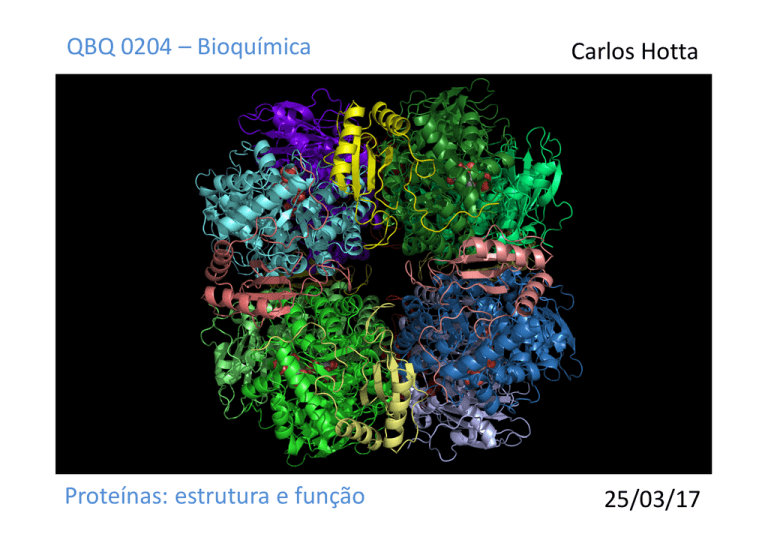
Estrutura quaternária de proteínas
Proteínas podem ter múltiplas
subunidades proteicas ou de RNA
Enovelamento de proteínas
•
•
A estrutura final da proteína pode ser atingida de forma espontânea
Proteínas, conhecidas como chaperonas, podem ajudar no enovelamento
Desnaturação de proteínas
•
Proteínas podem perder a sua forma em algumas condições: temperatura, pH,
agentes redutores
Grupos prostéticos
•
Proteínas podem se ligar a grupos externos para funcionar ou manter a susa
estrutura
Zinc finger
hemoglobina
SDS-PAGE
SDS-PAGE
SDS desnatura proteínas
Deixa a proteína negativa
Oculta as cargas
SDS-PAGE












