Escola de Engenharia de Lorena - USP
Cinética Química – Capítulo 06 – Reações Reversíveis
1 – Introdução
Uma reação química reversível ou, mais simplesmente, uma reação reversível é uma reação química que
ocorre em ambas às direções. Representa-se, de forma genérica, da seguinte maneira:
k2
onde R e S são formados na reação direta a partir dos reagentes A e B. E na
reação inversa, R e S reagem para formar A e B.
A+ B⇔R + S
k− 2
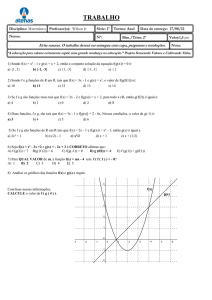
As reações reversíveis são aquelas nas quais, decorrido um tempo de reação, atinge-se o Equilíbrio
Químico, situação na qual a proporção entre as quantidades de reagentes e produtos da reação química se
mantém constante ao longo do tempo, a temperatura constante.
Para um observador externo, a impressão que se tem é que a reação química parou. Entretanto, do ponto
de vista microscópico, o que de fato ocorre é que a velocidade da reação direta se iguala a velocidade da
reação inversa quando se atinge o equilíbrio químico. Neste momento, a velocidade global da reação
química é zero, pois as velocidades das reações direta e inversa se igualam.
Fonte: Wikipédia
Fonte: Wikipédia
Exemplificando para uma reação química elementar de segunda ordem direta e de segunda ordem inversa,
cuja estequiometria, seja do tipo:
k2
tem-se para a reação direta que:
rdireta = k 2C AC B
e para a reação inversa que:
rinversa = k −2C R C S
A+ B⇔R + S
k− 2
Neste caso, a velocidade da reação é a diferença entre as velocidades da reação direta e inversa, ou seja:
d CR
dt
=−
d CA
dt
= k 2 C AC B − k − 2 C R C s
2 – Estudo Cinético pelo Modelo Integral
2.1 - Reações Reversíveis de Primeira Ordem Direta e Inversa:
Este é o caso mais simples de reações reversíveis, no qual:
k1
A ⇔ R
k −1
onde
KC =
CRe
k
= 1 = constante de equilibrio
CAe k −1
No equilíbrio químico, tem-se que a velocidade da reação é zero, ou seja : (-dCA/dt) = 0 .
Neste caso, a constante de equilíbrio pode-se ser deduzida em função da conversão de A no equilíbrio (XAe):
_____________________________________________________1
Notas de Aula - Prof. Dr. Marco Antonio Pereira
Escola de Engenharia de Lorena - USP
Cinética Química – Capítulo 06 – Reações Reversíveis
CR e
KC =
CA e
=
k1 M + X A e
=
k −1 1 − X A e
d CR
A equação de velocidade para a reação elementar é:
ou: C A
o
Considerando
M=
CRo
CAo
dXA
dt
,
dt
= k 1 C Ao (1 − X
A
=−
d CA
dt
) − k −1 C
tem-se que :
d XA
Ro
= k1CA − k −1CR
+ C Ao . X A
= k1(1 − X A ) − k −1( M + X A )
dt
Após os ajustes algébricos, realiza-se a integração e obtêm-se:
M +1
X
.t
− ln 1 − A = k 1
+
X
M
X
Ae
Ae
ou
CA − C A
M +1
e
. t
− ln
=
k
1
C
−
C
M
+
X
Ao
Ae
Ae
onde
M=
CRo
CAo
2.2 - Reações Reversíveis de Segunda Ordem Direta e Inversa:
k2
Seja a reação de segunda ordem direta e reversa:
A+B ⇔ R+S
k −2
A equação de velocidade para a reação elementar é:
d CR
dt
=−
d CA
dt
= k 2 C AC B − k − 2 C R C s
Realizando esta reação a partir das seguintes condições iniciais: C A = C B e C R = CS = 0,
o
o
o
o
utilizando o método integral, obtêm-se a seguinte equação matemática para o estudar esta reação:
ln
e
1
X Ae − (2 X Ae − 1) X A
= 2k 2
− 1C Ao t
XA
X Ae − X A
e
Esta condição inicial adotada: C A = C B e C R = CS = 0, é extensiva para as seguintes situações :
o
o
o
o
2A ⇔
R+S
ou
2A ⇔
2R
ou
A+B ⇔
2R
2.3 – Reação Reversível de Primeira Ordem Direta e Segunda Ordem Inversa
Seja a reação
n=1,k1
A
⇔
n=2,k2
R
+
S
onde
C Bo = CC o = 0 , tem-se que
k1 t =
X Ae
2 − X Ae
X Ae
X Ae
− ln
ln
1 − X Ae
X Ae − X A
XA
+ XA
1
−
X
A
e
_____________________________________________________2
Notas de Aula - Prof. Dr. Marco Antonio Pereira