PRODUÇÃO INDUSTRIAL DO AMONÍACO
A reação de síntese do amoníaco é uma reação reversível. As equações
químicas das reações das reações reversíveis contêm duas setas de
sentidos opostos a separar reagentes e produtos de reação.
Reagentes
Produtos de reação
A seta “” indica a reação direta e a seta “” indica a reação inversa.
Normalmente, uma reação reversível dá origem a um estado de equilíbrio
químico.
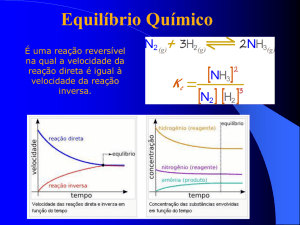
ESTADO DE EQUILÍBRIO QUÍMICO
Macroscopicamente, quando um sistema se encontra em equilíbrio
químico, a uma dada temperatura, não se registam mudanças observáveis
nas propriedades físico-químicas ao longo do tempo (cor, concentração,
temperatura e outras). No entanto, a reação não para, os reagentes
continuam a formar os produtos de reação e estes últimos a formarem os
reagentes (equilíbrio dinâmico).
REAÇÕES REVERSÍVEIS EM SITUAÇÃO DE NÃO EQUILÍBRIO
Existem reações reversíveis em situação de equilíbrio, como é o caso da
reação que ocorre na estratosfera por ação da radiação ultravioleta:
2 O3 (g)
3 O 2 (g)
Este processo reversível natural manteria a concentração de ozono
constante na estratosfera, se este não fosse destruído por agentes
antropogénicos.
ASPECTOS QUANTITATIVOS DO EQUILÍBRIO QUÍMICO
Numa reação em que é atingido um estado de equilíbrio, pode-se calcular
a relação entre produtos e reagentes através da constante de equilíbrio
(Kc).
Para uma dada reação genérica:
aA bB
cC d D
A constante de equilíbrio é dada pela expressão:
| C |ce | D |de
Kc
| A |ae | B |eb
Sendo:
|A|e - valor da concentração de A em equilíbrio.
|B|e - valor da concentração de B em equilíbrio.
|C|e - valor da concentração de C em equilíbrio.
|D|e - valor da concentração de D em equilíbrio.
Um alto valor de constante de equilíbrio significa uma reação com um
rendimento elevado e um baixo valor de constante de equilíbrio significa
uma reação com um baixo rendimento.
RELAÇÃO ENTRE A CONSTANTE DE EQUILÍBRIO DA REAÇÃO
DIRETA E A CONSTANTE DE EQUILÍBRIO DA REAÇÃO INVERSA
Dada uma reação genérica:
A
B
A constante de equilíbrio é dada pela expressão:
Kc
| B |e
| A |e
A reação inversa da anterior é:
B
A
A constante de equilíbrio desta reação inversa é:
K c'
| A |e
| B |e
'
Se multiplicarmos K c por K c , obtemos:
K c K c'
| B |e | A |e
| A |e | B |e
Kc Kc' 1
Pela expressão obtida conclui-se que as constantes de equilíbrio das
reações direta e inversa são inversamente proporcionais.
EVOLUÇÃO DE UMA REAÇÃO DE EQUILÍBRIO QUÍMICO
Para uma dada reação genérica:
aA bB
cC d D
Partindo de quantidades iniciais de A e de B, respetivamente, Y e Z,
evolução desta reações pode apresentar-se na seguinte tabela:
n/mol
Início
Variação
Equilíbrio
A
Y
B
Z
C
0
D
0
ax
Y ax
bx
Z bx
cx
cx
dx
dx
QUOCIENTE DE REAÇÃO
O quociente de reação (Qc) exprime-se por uma expressão semelhante à
constante de equilíbrio (Kc), mas no primeiro caso as concentrações dos
reagentes e dos produtos de reação não são de equilíbrio.
Por comparação de Qc e Kc, pode prever-se o sentido da progressão da
reação de equilíbrio, existindo as seguintes situações:
Se Qc > Kc, há progressão no sentido inverso.
Se Qc = Kc, não há progressão.
Se Qc < Kc, há progressão no sentido direto.
FATORES QUE PODEM ALTERAR O ESTADO DE EQUILÍBRIO
Os fatores externos que podem alterar o estado de equilíbrio de uma
mistura reacional e que podem ser controlados experimentalmente são:
A temperatura.
A concentração.
A pressão.
LEI DE LE CHATELIER
Se algum fator externo provocar uma perturbação num sistema químico
em equilíbrio, este vai evoluir no sentido de contrariar essa perturbação
até ser atingido um novo estado de equilíbrio.
SENTIDO DE UMA REAÇÃO VERSUS ENTALPIA DA REAÇÃO
Se uma reação é exotérmica, a reação inversa é endotérmica.
Reagentes
exotérmica
endotérmica
Produtos de reação
H 0
Se uma reação é endotérmica, a reação inversa é exotérmica.
Reagentes
endotérmic
a
exotérmica
Produtos de reação
H 0
CATALISADOR
Um catalisador é uma substância que aumenta a velocidade de uma
reação, sem experimentar nenhuma alteração química permanente e que
não se consome na reação.
Para uma reação reversível, o catalisador faz com que o estado de
equilíbrio seja atingido mais rapidamente.
CATALISADOR
Um inibidor é um catalisador negativo, ou seja, diminui a velocidade da
reação.
CONTROLO E PRODUÇÃO DE AMONÍACO
O amoníaco, um dos componentes que é produzido em maior quantidade
à escala mundial, tal como outros produtos, a sua produção resulta do
compromisso entre a extensão e a velocidade da reação, o preço e a
segurança do processo.