Aula: 11
Temática: Equilíbrio Ácido-Base – Parte VI
Olá! Nesta aula continuaremos com o tema de equilíbrio ácido base. Acompanhe!
Hidrólise de Sais
Ao dissolver um sal em água, o pH resultante pode ser ácido, básico ou
neutro, dependendo da natureza desse sal:
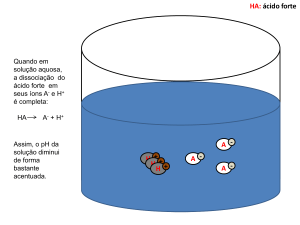
• Sal de ácido forte e base forte, a solução resultante é neutra (pH =
7), pois nenhum dos íons (ânion e cátion) sofrem hidrólise. Ex: NaCl,
K2SO4.
• Sal de ácido fraco e base forte, a solução resultante é básica (pH >
7), pois somente o ânion sofre hidrólise, aumentando a concentração
de íons OH–. Ex: NaF, K(CH3COO).
• Sal de ácido forte e base fraca, a solução resultante é ácida (pH <
7), pois somente o cátion sofre hidrólise, aumentando a concentração
de íons H3O+. Ex: NH4Cl, Al2(SO4)3.
• Sal de ácido e base fracos, a solução resultante é aproximadamente
neutra (pH 7), pois ambos os íons (ânion e cátion) sofrem hidrólise.
Para se determinar o pH da solução, precisamos conhecer os valores
de Kh para o cátion e para o ânion. Se o Kh para hidrólise do cátion (que
tende a tornar a solução ácida) for maior do que o Kh para hidrólise do
ânion (que tende a tornar a solução básica), a solução será ácida, por
causa de um pequeno excesso de íons H3O+. E vice-versa.
Sal de ácido forte e base forte:
Quando dissolvidos em água, apresentam reação neutra, pois nem os
ânions nem os cátions se combinam, respectivamente, com íons hidrogênio ou íons hidroxila para formar produtos levemente dissociados. O equilíbrio de dissociação da água H2O ↔ H+ + OH– não é, portanto, perturbado.
A concentração de íons hidrogênio na solução é igual à de íons hidroxila;
assim, a solução formada tem reação neutra.
QUÍMICA ANALÍTICA QUALITATIVA I
51
Sal de ácido fraco e base forte:
Podemos representar a hidrólise de um ânion A – como:
A–(aq) + H2O(l) ↔ HA(aq) + OH–(aq)
A reação consiste em remover os prótons das moléculas de água (H2O) para
formar moléculas de HA e íons hidróxidos (OH–), tornando assim, a solução
básica. Segundo Arrhenius, esta reação ocorre porque HA é um ácido fraco.
Dizer que HA é um ácido fraco equivale a afirmar que a ligação na molécula
de HA é forte o suficiente para evitar que esta molécula se dissocie completamente. O equilíbrio acontece quando A– é uma base suficientemente forte
para remover um próton da água ocorrendo a hidrólise do ânion.
Então:
Sal de ácido fraco e base forte = solução básica → hidrólise do ânion
Um ácido fraco de Arrhenius é o produto da hidrólise de um ânion e quanto
mais fraco for esse ácido maior o grau de hidrólise do ânion. Por exemplo,
pode-se prever que o ânion cianeto (CN–) hidrolise mais que o fluoreto (F–),
porque HCN é um ácido mais fraco do que HF.
(Ka HCN = 1,0 x 10–10
e
Ka HF = 6,7 x 10–4)
Quanto mais fraco um ácido, mas fortemente seu próton está ligado à
molécula e, consequentemente, maior a tendência de seu ânion hidrolisar
para formar a molécula do ácido. Pela definição de Bronsted-Lowry, quanto
mais fraco o ácido, mais forte será sua base conjugada.
O equilíbrio estabelecido quando o ânion A– hidrolisa é:
A–(aq) + H2O(l) ↔ HA(aq) + OH–(aq)
E para que esse equilíbrio seja estabelecido temos:
[HA].[OH- ]
[A - ]
Vamos denominar o valor resultante desse equilíbrio como constante de
hidrólise ou constante hidrolítica, e representar por Kh.
Normalmente não encontramos os valores dessas constantes em tabelas
prontas, pois podemos calculá-los com facilidade partindo de outros valores de constantes.
52
QUÍMICA ANALÍTICA QUALITATIVA I
Por Exemplo:
]
1º) [HA].[OH
condição de equilíbrio
-
[A ]
2º) Multiplicamos o numerador e o denominador da condição de equilíbrio
por [H+] e então obtemos a constante de hidrólise:
[HA].[OH -][H
]
Kh
-
[A ].[H ]
Como:
Kw [H ].[OH ]
-
e
[HA]
(é o inverso de Ka)
[A ].[H ]
Então temos:
Kh 1 . Kw
Ka
Para ânions, portanto, a constante de hidrólise é dada por:
Kw
Kh =
Ka
Ka é a constante de dissociação de um ácido fraco formado durante a
hidrólise. Como estas constantes são bastante conhecidas e facilmente
disponíveis e o valor de Kw é constante (10–14), fica fácil calcular o valor
de Kh para ser usado num cálculo de hidrólise.
Com relação ao cálculo do pH de uma solução salina deste tipo, temos que:
Kh
pH 1pKw 1 pKa -1 pC
; x
222
C
Onde:
QUÍMICA ANALÍTICA QUALITATIVA I
53
Kw é a constante de ionização da água. = 10–14
Ka é a constante de ionização do ácido.
C é a concentração molar do sal produzido.
é dado por : pC = –log [sal]
x é o grau de hidrólise (fração de cada molécula do ânion hidrolisada no
equilíbrio).
Vimos nesta aula como calcular o pH de uma solução salina.
Na próxima aula continuaremos a explorar esse assunto.
54
QUÍMICA ANALÍTICA QUALITATIVA I