QUÍMICA na abordagem do cotidiano
Tema
• TITO CANTO
Sais
12
Neutralização ácido-base
H⫹ ⫹ OH⫺
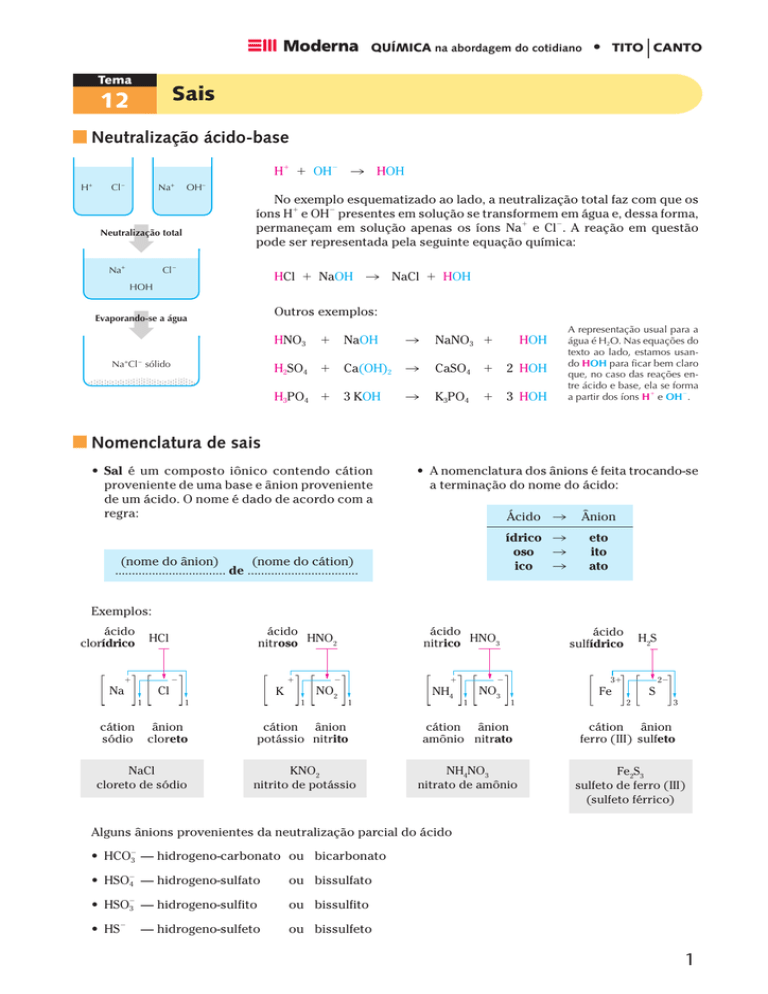
H+
Cl –
Na+
No exemplo esquematizado ao lado, a neutralização total faz com que os
íons H⫹ e OH⫺ presentes em solução se transformem em água e, dessa forma,
permaneçam em solução apenas os íons Na⫹ e Cl⫺. A reação em questão
pode ser representada pela seguinte equação química:
Neutralização total
Na+
촞 HOH
OH–
Cl –
HCl ⫹ NaOH
HOH
촞 NaCl ⫹ HOH
Outros exemplos:
Evaporando-se a água
NaOH
촞
NaNO3 ⫹
HOH
H2SO4 ⫹
Ca(OH)2
촞
CaSO4 ⫹
2 HOH
H3PO4 ⫹
3 KOH
촞
K3PO4
⫹
3 HOH
HNO3
Na+Cl – sólido
⫹
A representação usual para a
água é H2O. Nas equações do
texto ao lado, estamos usando HOH para ficar bem claro
que, no caso das reações entre ácido e base, ela se forma
a partir dos íons H⫹ e OH⫺.
Nomenclatura de sais
• Sal é um composto iônico contendo cátion
proveniente de uma base e ânion proveniente
de um ácido. O nome é dado de acordo com a
regra:
• A nomenclatura dos ânions é feita trocando-se
a terminação do nome do ácido:
(nome do ânion)
(nome do cátion)
................................. de .................................
Ácido 촞
Ânion
ídrico 촞
oso 촞
ico
촞
eto
ito
ato
Exemplos:
ácido
clorídrico
⫹
⫺
⫹
Cl
Na
1
cátion
sódio
ácido
nitroso HNO2
HCl
⫺
K
1
1
ânion
cloreto
NaCl
cloreto de sódio
ácido
nitrico HNO3
NO2
⫹
1
NH4
ácido
sulfídrico
⫺
1
NO3
H2S
3⫹
2⫺
S
Fe
1
2
3
cátion ânion
potássio nitrito
cátion ânion
amônio nitrato
cátion ânion
ferro (III) sulfeto
KNO2
nitrito de potássio
NH4NO3
nitrato de amônio
Fe2S3
sulfeto de ferro (III)
(sulfeto férrico)
Alguns ânions provenientes da neutralização parcial do ácido
• HCO⫺3 — hidrogeno-carbonato ou bicarbonato
• HSO⫺4 — hidrogeno-sulfato
ou bissulfato
• HSO⫺3 — hidrogeno-sulfito
ou bissulfito
• HS⫺
ou bissulfeto
— hidrogeno-sulfeto
1