Ácidos, bases e
sistemas tampão
Ionizaç
Ionização da água
• A água pura tem uma baixa concentração de
iões hidrónio (H3O+) e uma igual concentração
de iões hidróxido (OH-)
• Os ácidos são dadores de protões (e.g. H3O+) e
as bases são aceitadores de protões (e.g. OH-)
1
A escala de pH
• o pH é definido como o logaritmo do
inverso da concentração de H+
Relaç
Relação de [H+], [OH-] e o pH
2
Neutro
Básico
Substância
NaOH 1M
Amoníaco
Água do mar
Sangue
Leite
Saliva
Sumo de tomate
Vinagre
Suco gástrico
HCl 1M
pH
14.0
12.0
8.0
7.4
7.0
6.6
4.4
3.0
1.5
0
mais básico
mais ácido
concentração do ião (M)
Ácido
3
Variação de pH e
necessidade do seu
controlo
Metabolismo: grande nº de oxidações/reduções
4
É importante regular o pH da
célula porque:
1. as biomoléculas possuem grupos ionizáveis
que se comportam como ácidos ou como bases
Reactividade
química
5
É importante regular o pH da
célula porque:
1. as biomoléculas possuem grupos ionizáveis
que se comportam como ácidos ou como
bases
2. o controlo do pH assegura que os grupos se
encontrem na forma iónica (protonizada ou
não-protonizada), adequada à sua função
estrutura
interacção
6
Metabolismo produz continuamente
substâncias acídicas
- em maior quantidade: H2CO3 (ác. carbónico)
- mas também: ácido lá
láctico, cetoceto-ácidos …
- é necessário remover H+ continuamente
- é necessário manter o pH das células
e fluidos intersticiais
Tem que haver sistemas Tampão
7
Por exemplo, o que se passa no sangue?
pH sangue:
sangue: 7,35 (venoso) - 7,45 (arterial)
(arterial)
pH < 7,35
Acidose coma
pH > 7,45
Alcalose
tétano
pH incompatível com a vida:
pH ≤ 7,0
pH ≥ 7,8
O sistema bicarbonato é o principal tampão
do sangue
8
Sistemas tampão
Dissociaç
Dissociação de ácidos e bases:
• Os ácidos e as bases fortes dissociam-se
completamente na água:
HCl + H2O
Cl- + H3O+
• Cl- é a base conjugada do HCl
• H3O+ é o ácido conjugado of H2O
9
O ácido acé
acético é um ácido fraco
• Os ácidos fracos e as bases não se
dissociam completamente em H2O
ácido conjugado
base conjugada
Ka =
[CH3COO-] [H+]
[CH3COOH]
= 1.76 x 10-5 M
pKa= log 1 = 4.8
Ka
10
- voltando à dissociação dum ácido fraco:
HA
Ka =
Ka
H+ + A-
[H+] [A-]
[H+] = Ka
[HA]
- log [H+] = -log Ka - log
pH
[HA]
[A-]
[HA]
[A-]
pKa
[A-]
pH=pKa + log
[HA]
equação de
Henderson
Hasselbach
A equação de Henderson-Hasselbalch:
[A-]
pH=pKa + log
[HA]
• Define o pH duma solução em termos
de:
(1) O pKa do ácido fraco
(2) As concentrações do ácido fraco
[HA] e da base conjugada [A-]
11
Curva de titulação do ácido acético
(CH3COOH)
• As curvas de
titulação permitem
determinar os
valores de pKa
pH=pKa + log
[A-]
[HA]
Curva de
titulação do
ácido fosfórico
(H3PO4)
12
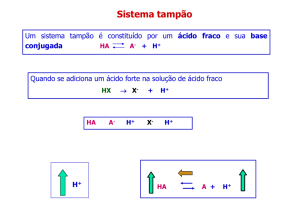
Ácidos e bases fracas – noção de TAMPÃO
(solução que resiste a mudanças de pH)
1. adiç
adição de um ácido
2. adiç
adição de uma base
13
• A capacidade de tamponização é a capacidade
que uma solução tem de resistir a mudanças de
pH
• A maior capacidade de tamponização ocorre
quando:
pH solução = pKa do tampão
• Neste ponto: [ácido fraco] = [base conjugada]
• A capacidade de tamponização é geralmente a
valores de pH iguais a pKa ± 1 unidade de pH
pKa do par
ácidocido-base
14
15
≠s fluidos bioló
biológicos ⇒ ≠s funç
funções ⇒ enzimas com ≠s óptimos de pH:
Fluido
pH
Plasma sanguíneo
7.4
Citossol (cél.fígado)
6.9
Lisossomas (fígado)
<5.0
Suco gástrico
1.5-3.0
Suco pancreático
7.8-8.0
⇒ necessidade de sistemas tampão para manter o pH
dentro de limites estreitos
variaçções do pH sangu
sanguííneo na sa
saú
úde humana:
Efeito de varia
8.2
morte por tetania
7.8
alcalose
pH
7.4
variação normal
acidose
7.0
morte por coma
6.6
16
pKa e anestésicos locais
- a transmissão do impulso nervoso ocorre sob a forma dum
potencial de acção, que envolve um influxo de Na+ para o
interior do axónio do nervo
o bloqueio é
feito através
do lado do
citossol
17
- muitos anestésicos locais têm esta estrutura genérica:
H
grupo
aromático
H
ligação
éster ou
amida
cadeia
intermediária
grupo
amina
grupo ionizável:
NH2 + H+
NH3+
AH+ - forma protonada
A: - forma sem carga
(injecção)
Fluido extracelular
(pH mais alto)
canal de
sódio
Fluido intracelular
(pH mais baixo)
18
Hiato aniónico
19
O fluido extracelular é electroneutro, i.e.,
[cargas positivas] = [cargas negativas]
[Na+] + CNM = [Cl-] + [HCO3-] + ANM
CNM – catiões não medidos (ex., K+, Ca2+, algumas gama-globulinas)
ANM – aniões não medidos (ex., albumina, sulfato, fosfato, lactato)
Hiato aniónico:
HA = ANM - CNM = [Na+] –([Cl-] + [HCO3-])
Hiato aniónico
HA = ANM - CNM = [Na+] –([Cl-] + [HCO3-])
valor normal: 9-16 mEq/litro
HA elevado:
produção excessiva de um ácido endógeno
(ex: cetoacidose, acidose láctica, acidose
urémica)
ou adição de um ácido exógeno (ex:
intoxicação por metanol, que é metabolizado a
ácido fórmico)
20