Sistema tampão
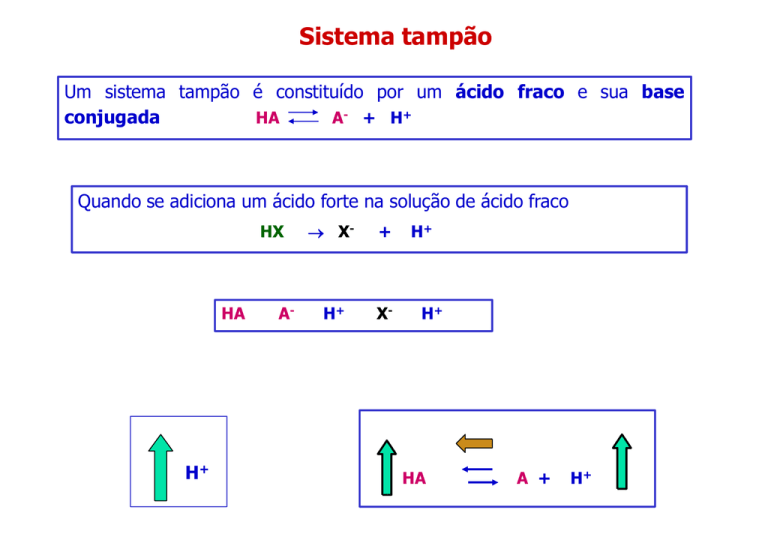
Um sistema tampão é constituído por um ácido fraco e sua base
conjugada
HA
A- + H +
Quando se adiciona um ácido forte na solução de ácido fraco
HX
HA
H+
A-
→ X-
+
H+
X-
H+
H+
HA
A +
H+
Sistema tampão
Quando se adiciona um álcali na solução de ácido fraco
BOH
HA
OH- + H+
A-
→ B
+ OH-
+ H+
H2O
Resultado
H+
HA
A- +
H+
EQUAÇÃO DE HENDERSON-HASSELBACH
Equação de Henderson-Hasselbach
relaciona a Keq (Ka) e as [Ácido fraco] e [Base conjugada]
Ka = [A-] [H+]
[H+] = Ka [HA]
[A-]
[HA]
log [H+]
=
log Ka
+ log [HA]
[A-]
Equação de Henderson-Hasselbach
log [H+]
=
log Ka
+ log [HA]
[A-]
log [H+]
=
log Ka
-
log [A-]
[HA]
- log [H+]
=-
log Ka
+
log [A-]
[HA]
pH = pKa + log [A-]
[HA]
A eficiência de um tampão está restrita a
uma faixa de pH
pH = pKa + log [A-]
pH = pKa + log [base conjugada]
[HA]
[ácido fraco]
pKa = pH que provoca 50% de dissociação do ácido
[HA] = [A-]
A eficiência máxima de um tampão é no pH
correspondente a seu pKa
*Depende também da concentração das espécies
Características de Tampões
Ácido
Base
Ka
Conjugada
pKa
(pH ácido 50% dissociado)
H3PO4
H2PO4-
7,2 x 10-3
2,14
Acético
Acetato
1,7 x 10-5
4,76
H2CO3
HCO3-
4,3 x 10-7
6,36
NH4+
NH3
5,6 x 10-10
9,25
Considerando-se uma solução tampão fosfato (HPO4-/HPO42-), em
que ambas as espécies têm concentração de 0,10 mol.L-1, calcular o
pH desta solução.
Dado: pKa = 6,86
Calcular o pH de uma solução tampão acetato (HAc/Ac-), em que a
concentração do HAc é de 0,10 mol.L-1 e a concentração de Ac- é
de 0,20 mol.L-1.
Dado: pKa = 4,76
Calcular as concentrações de HAc e Ac- em uma solução tampão
acetato 0,5 mol.L-1, que apresenta pH igual a 5,5.
Dado: pKa = 4,76












