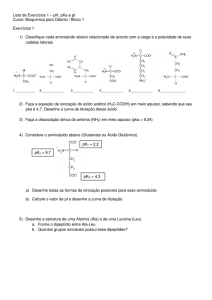
QFL-2340 – Estrutura e Propriedades de Compostos Orgânicos – Diurno
Lista extra 2 – Ácidos e Bases (introdução) – 2008
1. Definir ácido e base de BrØnsted-Lowry e ácido e base de Lewis. Qual a definição
mais abrangente? Justifique.
2. (a) Dê o conceito de pKa e Ka
(b) Um ácido tem um Ka de 4,53.10-6 em água. Qual é seu Keq? ([H2O]=55,5M)
(c) Qual é o ácido mais forte, um com uma constante de dissociação ácida de 3,4.10-3
ou um com uma constante de dissociação ácida de 2,1.10-4?
3. Calcule o Ka para cada um dos seguintes ácidos e coloque-os em ordem
decrescente de acidez.
(a) aspirina, pKa = 3,48
(b) vitamina C, pKa = 4,17
(c) ácido oxálico, pKa = 1,19
4. Usando os valores de pKa, coloque as forças das bases em ordem decrescente:
CH3NH 2
CH3NH-
CH3OH
CH3O-
CH3COO-
* respectivos valores de pKa = 3,48 10,7 ; 40; -2,5; 15,5; 4,8.
(b) Qual é a base mais forte, CH3COO- ou HCOO-? (pKa = 4,8 e 3,8; respectivamente).
5. Dê os produtos das seguintes reações e identifique o ácido, a base, o ácido
conjugado, e a base conjugada
O
CH3CH2O- + CH3COH
(CH3)2CHOH + H2NHI + HO6. Cianeto de hidrogênio (HCN) possui um pKa = 9,1. Qual o valor de seu Ka? HCN é
um ácido forte ou fraco? O íon cianeto (CN-) é uma base mais forte ou mais fraca que
o íon hidróxido?