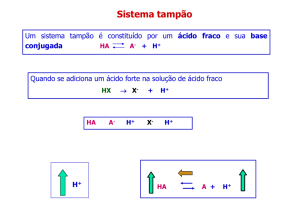
SOLUÇÃO TAMPÃO
-
é uma solução que sofre pequena variação de pH quando a ela são adicionados H + ou
OHé uma solução que contém um ácido mais a sua base conjugada, em concentrações
aproximadamente iguais
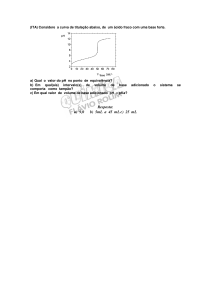
é uma característica de uma curva de titulação ácido fraco base forte, é um aumento
no pH inicial seguido de um intervalo no qual o pH permanece relativamente constante,
mesmo que continue sendo adicionada uma base. Uma situação semelhante ocorre em
curvas de titulação ácido forte-base fraca. A resposta lenta do pH à adição de ácido ou
base indica a ação tampão da solução.
Tipos de solução tampão:
1.
2.
3.
4.
ácido fraco + sal derivado de ácido fraco e base forte
base fraca + sal derivado de base fraca + ácido forte
dois sais
adição de ácido forte ou base forte a um sal
ÁCIDOS E BASES CONJUGADOS
Os produtos de uma reação entre um ácido e uma base também podem ser classificados
como um ácido e uma base:
ÁCIDO ACÉTICO
METILAMINA
Ácido
ÍON ACETATO
ÍON METILAMÔNIO
base
Par conjugado
Base
Par conjugado
ácido
O íon acetato é uma base pois pode aceitar um próton para produzir ácido acético. Dizemos
que o ácido acético e o íon acetato são um para ácido-base conjugado.
ÁCIDOS E BASES CONJUGADOS ESTÃO RELACIONADOS ENTRE SÍ PELO
GANHO OU PERDA DE UM H+.
Nota:
- A maioria dos ácidos carboxílicos são ácidos fracos e a maioria dos ânions carboxilados é
base fraca.
- As aminas são bases fracas e os íons amônio são ácidos fracos.
- A base conjugada de um ácido fraco é uma base fraca. O ácido conjugado de uma base
fraca é um ácido conjugado.
- A ação tampão é o equilíbrio entre um ácido fraco e seus sais
Ex: ÁCIDO ACÉTICO E ÍONS ACETATO
[H+] . [CH3COO-]
Ka =
[H+]
[CH3COOH]
=
Ka . [CH3COOH]
[CH3COO-]
Se tomarmos o logarítmo negativo de todos os lados:
+
- log [H ]
=
- log Ka - log
pH = pKa - log
[CH3COOH]
[CH3COO-]
[CH3COOH]
[CH3COO-]
Equação de Henderson-Hasselbalch
pK se refere ao logaritmo negativo de uma constante de equilíbrio . Quando K aumenta, sua
função p decresce e vice-versa.
- quanto maior o Ka e menor o pKa mais forte é o ácido.
CAPACIDADE TAMPONANTE,
È A MEDIDA DE QUANTO UMA SOLUÇÃO RESISTE A MUDANÇA NO pH quando um ácido ou
uma base forte é adicionada.
= d Cb = - d Ca
d pH
d pH
onde Ca e Cb são o número de moles de ácido forte e de base forte por litro necessários
para produzir a mudança de uma unidade no pH. Quanto maior for o valor de , mais
resistente a variação de pH será a solução.
A característica mais notável da capacidade tamponante é que ela alcança um máximo
quando pH = pKa, ou seja, um tampão é mais eficaz em resistir a mudança de pH quando pH
= pKa, isto é, [HÁ] = [A-].
Na escolha de um tampão para um experimento, deve-se buscar um cujo pKa seja o
mais próximo posível do pH desejado. A faixa de pH útil de um tampão geralmente é
considerada pKa 1unidade de pH. A capacidade tamponante também pode ser aumentada
aumentado a concentração do tampão.
Exercícios:
1.
[C2H4O2] = [C2H3O2-] = 1 MOL/l. Adicionou-se 0,1 mol de OH- por litro. A relação
ácido acético/íon acetato muda para:
[C2H4O2] /[C2H3O2-] = 1-0,1 / 1+0,1 = 0,82
como log 0,82 = 0,09 isto significa de acordo coma equação de Equação de HendersonHasselbalch que o novo pH será:
pH = 4,74 - (- 0,09) = 4,83
2.
Compare o efeito do pH na adição de 0,1 mol/L de H+ a 1 L de:
a) tampão ácido fórmico – formiato [CH2O2] = [CHO2-] = 1 mol/L
b) água
a) tampão ácido fórmico – formiato [CH2O2] = [CHO2-] = 1 mol/L
pH = pKa - log [CH2O2] / [CHO2-]
pH = 3,74 - log 1/1 = 3,74
com a adição de 0,1 mol de H+:
pH = pKa - log [CH2O2] + H+:/ [CHO2-] - H+
pH = 3,74 - log 1 + 0,1 /1 – 0,1 = 3,74 - log 1,1/0,9 = 3,65
b) a água não é tamponada
H2O + H2O H3O+(aq) + OH-(aq)
Não estão presente o par ácido-base conjugada em concentrações iguais, portanto a variação do pH da
água é muito suscetível a ação de ácidos e bases.
3. Calcule a variação no pH produzido pela adição de 0,2 mol/L do tampão ácido fórmico-formiato
pH = 3,74 - log 0,8 / 1,2 = 3,92
Tampões em sistamas biológicos:
O sangue humano é tamponado por uma série de sistemas incluindo:
H2PO4-(aq) HPO42-(aq) + H+(aq) pKA = 7,20
H2CO3(aq)_ 2CO3-(aq) + H+(aq) pKA = 6,38