ENZIMAS
Enzimas são proteínas especializadas que funcionam na
aceleração de reações químicas.
Função: catalisadores biológicos.
exceção:
grupo de RNA catalítico
(ribozimas)
Importância da catálise:
Sem a catálise, a maioria das reações químicas nos
sistemas biológicos seria muito lenta para fornecer produtos
na proporção adequada para sustentar a vida.
* Uma enzima pode ficar, temporariamente, ligada
covalentemente à molécula que está sendo transformada
durante estágios intermediários da reação, mas no final da
reação a enzima estará na sua forma original, quando o
produto é liberado.
ENZIMAS
* As enzimas podem aumentar a velocidade de uma
reação por um fator de até 1017 vezes mais do que
a reação não catalisada.
Propriedades das Enzimas
• São catalisadores biológicos extremamente eficientes e aceleram a
velocidade da reação, transformando de 100 a 1000 moléculas de
substrato em produto por minuto de reação.
• Atuam em concentrações muito baixas
• Atuam em condições específicas de temperatura e pH
• Possuem todas as características das proteínas
• Podem ter sua concentração e atividade reguladas
• Estão quase sempre dentro da célula, e compartimentalizadas.
ENZIMAS
As enzimas apresentam um alto grau de
especificidade:
cada
enzima
possui
uma
organização estrutural específica, permitindo a
ligação apenas do(s) seu(s) substrato(s).
*há enzimas que aceitam como substrato qualquer
açúcar de seis carbonos, enquanto outras só
reconhecem a glicose.
As enzimas são fundamentais para processos
bioquímicos celulares tais como:
- degradação das moléculas nutrientes;
- transformação e conservação da energia química;
- síntese de macromoléculas biológicas a partir de
moléculas precursoras simples;
ENZIMAS
Importância prática do estudo das enzimas:
- em algumas doenças, especialmente nas desordens genéticas
herdadas, pode ocorrer uma deficiência ou mesmo a ausência
total de uma ou mais enzimas. Ex: fenilcetonúria (fenilalanina
hidroxilase); doença de von Gierke (glicose-6-fosfatase hepática)
- condições anormais podem ser causadas pela
atividade excessiva de uma enzima;
- medidas da atividade de enzimas no plasma
sangüíneo, eritrócitos ou amostras de tecido são
importantes no diagnóstico de várias doenças; VER
- muitos fármacos exercem seu efeito biológico por
meio de interações com as enzimas.
Enzimas na Clínica
As enzimas podem ser utilizadas nas Análises Clínicas de 2 formas
principais:
• Como reagentes altamente específicos e sensíveis em reações
colorimétricas quantitativas
• Como indicadoras de lesão celular e tecidual: o extravasamento de
enzimas do meio intra para o meio extracelular leva a um aumento da
atividade destas no sangue; esta atividade pode ser medida e fornece
importante informação diagnóstica e de evolução de um quadro clínico. A
distribuição órgão-específica de algumas destas enzimas permite a
localização da lesão com bastante precisão.
Exemplos de doenças que podem
acompanhadas enzimaticamente são:
ser
diagnosticadas
e
• Infarto Agudo do Miocárdio (Creatina quinase, Lactato desidrogenase)
• Hepatite (Transaminases: ALT, AST)
• Pancreatite (Amilase, Lipase)
VOLTAR
• Câncer de próstata (Fosfatase ácida prostática)
Nomenclatura das enzimas
Existem 3 métodos para nomenclatura enzimática:
• Nome Oficial: Mais complexo, nos dá informações
precisas sobre a função metabólica da enzima. Ex:
ATP:Glicose:Fosfo-Transferase
EC X.X.X.X (Enzyme Commission)
• Nome Clássico: Mais curto e utilizado no dia a dia de
quem trabalha com enzimas; utiliza o sufixo "ase" para
caracterizar a enzima. Ex: Urease, Hexoquinase,
Peptidase, etc.
• Nome Trivial: Consagrados pelo uso. Ex: Tripsina,
Pepsina, Ptialina.
ENZIMAS
Muitas enzimas são nomeadas pela adição do
sufixo “ase” ao nome do seu substrato, ou à palavra
ou frase que descreve sua atividade:
- urease = catalisa a hidrólise da uréia
- DNA polimerase = catalisa a polimerização dos
nucleotídeos para formar o DNA
ENZIMAS
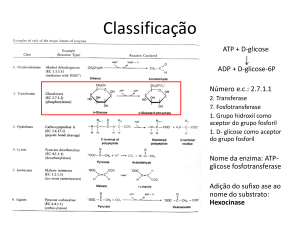
Classificação das Enzimas
As enzimas são divididas em seis grandes classes,
cada uma com subclasses, de acordo com o tipo de
reação que catalisam:
Classe 1: Óxido-redutases → transferência de elétrons (íons
hidreto ou átomos de H). Ex: desidrogenases, redutases, oxidases e
peroxidases.
* Oxidação do etanol pela álcool desidrogenase.
Classe 2: Transferases → reações de transferência de grupos.
Ex: quinases, transcarboxilases e aminotransferases.
* Reação catalisada por uma aminotransferase.
Classe 3: Hidrolases → reações de hidrólise. Ex: amilase, urease,
pepsina, tripsina, quimotripsina e várias peptidases e esterases.
Classe 4: Liases → adição de grupos às duplas ligações ou
formação de duplas ligações por meio de remoção de grupos.
* A reação da fumarase.
Classe 5: Isomerases → transferência de grupos dentro da mesma
molécula para formar isômeros.
Classe 6: Ligases → reações de síntese, onde duas moléculas são
unidas, às custas de uma ligação fosfato de alta energia do ATP.
* Reação da piruvato carboxilase.
ENZIMAS
Como as enzimas funcionam?
- as enzimas aceleram a velocidade das reações
por diminuir sua energia de ativação: vídeo
A combinação do substrato com a enzima cria uma nova via de
reação que tem um estado de transição de menor energia do
que na ausência do substrato. vídeo
ENZIMAS
Interação enzima-substrato:
- a ligação com o substrato dá-se em uma região
pequena e bem definida da enzima, chamada centro
ativo (ou sítio ativo);
- o centro ativo é formado por resíduos de aminoácidos e
constitui uma cavidade com forma definida, que permite à
enzima “reconhecer” seu substrato; vídeo
- uma molécula, para ser aceita como substrato, deve ter
a forma espacial adequada para alojar-se no centro ativo
e grupos químicos capazes de estabelecer ligações com
os radicais do centro ativo;
vídeo
ENZIMAS
Interação enzima-substrato:
* a relação substrato-enzima não deve ser entendida
como um modelo rígido de chave-fechadura (este modelo
exemplifica a especificidade de uma enzima pelo seu
substrato, mas não explica toda a complexidade da
relação estabelecida entre eles durante a catálise);
- na verdade, a aproximação e a ligação do substrato
induz na enzima uma mudança conformacional,
tornando-a ideal para a catálise (modelo do ajuste
induzido)
Modelo da chave-fechadura.
Modelo do ajuste induzido e tensão do substrato:
a) Aproximação entre substrato e enzima induz a formação do sítio
ativo.
b) Tensão no substrato induzida pela ligação do substrato à
enzima, contorce os ângulos normais de ligação e “ativa” o
substrato.
ENZIMAS
Fatores que interferem na atividade enzimática:
- a estrutura e a forma do centro ativo são uma
decorrência da estrutura tridimensional da enzima e
podem ser afetadas por quaisquer agentes capazes de
provocar mudanças conformacionais na proteína;
- portanto, a atividade enzimática é dependente das
características do meio, principalmente do pH e da
temperatura;
Velocidade de formação do produto
As enzimas têm um pH ótimo (ou um intervalo de pH) no qual a sua
atividade é máxima: em um pH maior ou menor, a atividade diminui.
Velocidade de formação do produto
Fosfatase alcalina:
pH ótimo = 10
Como ocorre com a maioria das reações químicas, a velocidade da reação
enzimática, que a 0°C apresenta valores próximos de zero, é favorecida pela
elevação da temperatura.
* O gradativo aumento da velocidade só se verifica enquanto a enzima
conservar a sua estrutura nativa.
ENZIMAS
Inibidores Enzimáticos:
- a atividade enzimática pode ser diminuída por várias
substâncias (constituintes normais ou estranhas às
células) provocando alterações significativas no
organismo;
- os inibidores normalmente encontrados nas células
constituem um mecanismo importante de controle da
atividade enzimática;
- o uso in vitro de inibidores tem trazido um grande
conhecimento sobre a estrutura das enzimas, a
organização do centro ativo e o mecanismo de catálise.
ENZIMAS
Inibidores Enzimáticos:
- muitos medicamentos de uso na prática terapêutica
baseiam suas propriedades na inibição específica de
certas enzimas;
- as propriedades tóxicas de muitos inibidores possibilita
também o seu emprego no combate contra insetos
(inseticidas);
*os inibidores enzimáticos podem ser agrupados em
duas categorias, de acordo com a estabilidade de sua
ligação com a molécula de enzima, em inibidores
reversíveis e irreversíveis.
ENZIMAS
Inibidores Enzimáticos:
-os inibidores reversíveis são divididos em dois grupos:
os competitivos e os não-competitivos, baseando-se na
competição (ou não) entre o inibidor e o substrato pelo
centro ativo da enzima;
* Os inibidores competitivos competem com o substrato pelo centro
ativo da enzima por apresentarem configuração espacial semelhante
à do substrato:
ENZIMAS
Inibidores Enzimáticos:
* Um exemplo clássico de inibição competitiva é a ação do malonato
sobre a reação catalisada pela succinato desidrogenase:
ENZIMAS
Inibidores Enzimáticos:
* Os inibidores não-competitivos não possuem qualquer semelhança
estrutural com o substrato da reação que inibem e seu efeito é
provocado pela ligação a radicais não pertencentes ao centro ativo.
*Ex: metais pesados como Hg2+, Pb2+ e Ag2+, que reagem com os
grupos -SH das proteínas.
ENZIMAS
Inibidores Enzimáticos:
-os inibidores irreversíveis reagem quimicamente com as
enzimas, levando a uma inativação praticamente
definitiva;
Ex: compostos organofosforados → formam ligações covalentes com
o grupo -OH de resíduos de serina
Aspirina → transfere seu grupo acetil para o grupo -OH de um
resíduo de serina na molécula da ciclooxigenase, inativando-a
Penicilina → liga-se especificamente as enzimas da via de síntese
da parede bacteriana, tornando-as susceptíveis à lise
ENZIMAS
Regulação da atividade enzimática:
* Basicamente, existem dois mecanismos para a regulação da
atividade enzimática:
1. Controle da disponibilidade de enzimas exercido sobre as
velocidades de síntese e de degradação das enzimas que
determinam sua concentração celular;
2. Controle da atividade da enzima, efetuado por mudanças
estruturais da molécula enzimática e que redundam em alterações
da velocidade de catálise.
*Este efeito pode ser exercido mediante união não-covalente de
moduladores (enzimas alostéricas), ou por modificação covalente da
enzima.
ENZIMAS
Regulação da atividade enzimática:
* As enzimas alostéricas funcionam por meio de ligação nãocovalente de compostos reguladores chamados moduladores
alostéricos.
* As enzimas alostéricas sofrem mudanças conformacionais em
resposta à ligação do modulador:
ENZIMAS
Regulação da atividade enzimática:
* A etapa reguladora em muitas vias metabólicas é catalisada por
uma enzima alostérica.
* Em alguns sistemas multienzimáticos, a enzima reguladora é
inibida pelo produto final da via sempre que a sua concentração
exceder as necessidades celulares:
*Inibição por feedback.
ENZIMAS
Regulação da atividade enzimática:
* Algumas enzimas reguladoras sofrem modificação covalente
reversível.
* Entre os grupos modificadores estão: fosfato, adenosina
monofosfato, uridila monofosfato, adenosina difosfato ribose e
grupos metila:
ENZIMAS
Regulação da atividade enzimática:
* Algumas enzimas são sintetizadas em uma forma inativa, o
zimogênio.
* Para que o zimogênio adquira as propriedades de enzima, é
necessário que haja hidrólise de determinadas ligações peptídicas e
conseqüente remoção da cadeia de aminoácidos.
ENZIMAS
Cofatores são imprescindíveis para a atividade de algumas enzimas:
* Muitas enzimas necessitam da associação com outras moléculas
ou íons para exercer seu papel catalítico.
* Esses componentes da reação enzimática são genericamente
chamados cofatores, os quais podem ser íons metálicos (Ca, Mg,
Mn, Fe, Cu, Ni, Co, Zn, Se e outros) ou moléculas orgânicas, nãoprotéicas (coenzimas).
Estes cofatores não estão ligados permanentemente à molécula da
enzima mas, na ausência deles, a enzima é inativa;
A fração protéica de uma enzima, na ausência do seu cofator, é
chamada de APOENZIMA;
Enzima + Cofator, chamamos de HOLOENZIMA.
ENZIMAS
Cofatores são imprescindíveis para a atividade de algumas enzimas:
* As enzimas que precisam de íons são chamadas metaloenzimas.
*Exemplos de metaloenzimas e seus correspondentes íons:
-Anidrase carbônica (Zn2+)
-Piruvato quinase (K+ , Mg2+)
-ATPase (Na+ , Mg2+)
-Urease (Ni2+)
* Papel do Mg na atividade da hexoquinase: o Mg
fica coordenado com o ATP, “enfraquecendo” a
ligação fosfato terminal do ATP, facilitando a
transferência do fosfato à glicose.
*Funções do Zn na
anidrase carbônica: o
Zn ligado à enzima
gera um próton e uma
hidroxila a partir da
água, que são então
adicionados ao CO2.
Zn2+ no mecanismo de reação da carboxipeptidase A. Zn2+ ligado a enzima gera uma hidroxila
nucleofílica a partir de água ligada, que ataca a carbonila da ligação peptídica, como indicado
pela seta. Glu 270 ajuda por puxar o próton da água ligada ao zinco. (Redesenhado de Lipscomb,
W. N. Robert A. Welch Found. Conf. Chem. Res. 15:140, 1971)
As coenzimas são geralmente derivadas de alguma vitamina hidrossolúvel:
* Nicotinamida adenina dinucleotídeo
(NAD+)