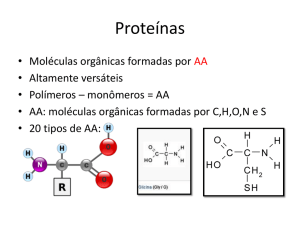
Metabolismo e Endocrinologia
Teórica-Pratica: 1
Tema:
1.Enzimologia
1.1 Noções de termodinâmica
1.2 Cinética
1.3 Inibição
2. Tópicos de resposta para a primeira teórico-prática
Data: 30.03.2011
1
1.1
ENZIMOLOGIA
NOÇÕES TEÓRICAS
A enzimologia é um ramo da bioquímica que estuda as reacções enzimáticas. As
enzimas são um grupo de substâncias orgânicas de natureza normalmente proteica, com
actividade intra ou extracelular que têm funções catalisadoras, catalisando reações químicas
que, sem a sua presença, dificilmente aconteceriam mesmo em condições biologicamente
favoráveis. Isto é, baixam a energia de activação necessária para que se dê uma reação
química, resultando no aumento da velocidade da reação e possibilitando o metabolismo dos
seres vivos.
1.1.1 NOÇÕES DE TERMODINÂMICA
A energia livre de um sistema, G, depende da entalpia, H, da entropia, S, e da
temperatura do sistema.
Numa reação a temperatura, T, constante, a variação de energia livre de Gibbs, ΔG,
está associada à variação da:
Entalpia, ΔH: calor libertado/absorvido durante a reação. Reflete o tipo e número de
ligações e interações quebradas e formadas;
o Se ΔH<0 há absorção de calor e a reação diz-se endotérmica;
o Se ΔH>0 há libertação de calor e a reação diz-se exotérmica;
Entropia, ΔS: variação da desordem do sistema. Se ΔS>0 há aumento da desordem. A
entropia dos sistemas tende sempre a aumentar.
ΔG é uma medida da energia disponível pelo sistema para a realização de trabalho,
aproxima-se do zero quando as reações tendem para o equilíbrio e prediz se uma reação é
espontânea. É independente do percurso da transformação, ou seja, é independente do
mecanismo molecular e não permite inferir sobre a velocidade de uma reação.
Se ΔG<0, a reação ocorre espontaneamente;
1
Se ΔG>0, a reação não ocorre espontaneamente;
Se ΔG=0, a reação encontra-se em equilíbrio;
Muitas das reações fundamentais do metabolismo celular, como a síntese de
proteínas e ácidos nucleicos, estão associadas a um ΔG positivo. Para contornar este facto e
tornar as reações termodinamicamente favoráveis as células recorrem ao acoplamento de
reações: ao acoplar uma reação desfavorável a uma reação com ΔG negativo, como a hidrólise
de ATP, consegue-se que o ΔG global (ΔG de reações consecutivas somam-se) seja negativo e,
portanto, que o processo global seja espontâneo.
A energia livre de uma reação também se pode relacionar com a sua energia livre
padrão, ΔG0, e o quociente de reação, Q:
R: constante dos gases ideais (R=8.314 J mol-1 K-1; R=1.987 cal mol-1 K-1);
T: temperatura (Kelvin);
Q: quociente de reação
Ou de outra forma, dada uma reação
ΔG0: energia livre padrão. Energia livre determinada a pH=0, T=25°C e em equilíbrio
químico.
Em equilíbrio Q=Keq e ΔG=0, pelo que
Quando Keq>>1, [P]>>[R] e ΔG0 é bastante negativo. Contrariamente, para Keq<<1,
[P]<<[R], a reação tende a ser completa e ΔG0 é bastante positivo.
ΔG é uma medida da diferença de energia
entre os produtos e os reagentes de uma reação.
No entanto, para que ocorra a transformação dos
reagentes em produtos é necessário quebrar
ligações e interações existentes entre as moléculas
e criar outras novas, passando-se por um estado
de transição que está associado a uma energia
Ilustração 1 - Ação das enzimas numa reação. 2
livre superior à dos reagentes. Essa energia, denominada energia de ativação, ΔG*, pode ser
diminuída pela ação de enzimas.
O centro ativo de uma enzima fornece uma superfície que complementa o estado de
transição de uma reação na sua estereoquímica, carga e polaridade, pelo que a ligação enzimasubstrato é exergónica. A energia libertada baixa a energia de ativação da reação e permite
que esta ocorra mais rapidamente.
Entre as características das enzimas podemos destacar:
São todas de natureza proteica, embora possam conter uma parte não proteica – o
cofator;
Baixam a energia do estado de transição, diminuindo a energia de ativação necessária
a uma reação – aceleram a sua velocidade (velocidade até 1016x superior!);
Não modificam a constante de equilíbrio K;
Encontram-se intactas no final da reação;
Têm elevada especificidade;
A sua atividade pode ser sujeita a controlo.
1.1.2 CINÉTICA
A reação entre uma enzima (E) e um substrato (S) de modo a dar um produto (P)
pode ser representada por:
(Numa fase inicial, assume-se que a reação inversa à formação do produto P é negligenciável
porque se verifica [P]~0 )
No estado de equilíbrio assume-se que não há formação de produto, pelo que
e
.
No estado estacionário assume-se que [ES] é constante, logo
.
A velocidade a que uma reação enzimática ocorre é, em geral, seguida através da
quantidade de produto formado por unidade de tempo,
. Numa fase inicial, a
variação de [P] em função do tempo é linear, pelo que se pode calcular a velocidade inicial da
reação (v0). Já a variação da velocidade com a concentração de substrato pode ser estimada a
partir da equação de Michaelis-Menten, que assume algumas condições:
Formação de um complexo ES enzima substrato;
Equilíbrio rápido entre o complexo ES e a enzima livre;
A dissociação de ES em E+P é mais lenta que a formação do complexo ES a partir de
E+S e que a reação inversa, a dissociação de ES para voltar a dar E+S.
Equação de Michaelis-Menten:
Velocidade máxima:
3
Vmax é a velocidade máxima da reacção quando há saturação da concentração do
substrato. É uma constante e representa um valor teórico pois nunca é alcançada na realidade
– implicaria que todas as enzimas estivessem ligadas ao substrato.
Constante de Michaelis:
Km, constante de Michaelis, é a constante de equilíbrio para a dissociação do
complexo ES e é definida como a concentração de substrato quando a velocidade de reação é
metade da velocidade máxima. É característica de cada enzima e não depende da
concentração do substrato.
É ainda uma medida da afinidade da enzima em relação ao seu substrato, sendo
1/Kmo valor dessa medida. Deste modo, quanto menor for o valor de K m maior é a afinidade
enzima-substrato e menor é a quantidade de substrato necessária para atingir metade da
velocidade máxima.
Pode ainda definir-se um último parâmetro, o turnover number, que se representa
por Kcat e é uma medida da actividade catalítica máxima de uma enzima. O Kcat é definido como
o número de moléculas de substrato que são convertidas em produto por molécula de enzima
e unidade de tempo quando a enzima está saturada de substrato.
O quociente
dá um índice da eficiência catalítica de uma enzima.
Os gráficos seguintes representam a curva de Michaelis para diferentes enzimas e
para diferentes concentrações de substrato, evidenciando os valores relativos de Km para cada
caso.
Ilustração 2 - Curvas de Michaelis.
A interpretação da cinética enzimática de Michaelis não estabelece uma relação
linear entre as grandezas em estudo, sendo mais difícil de manipular sem recurso a softwares
informáticos. Na cinética de Lineweaver-Burk representam-se as variáveis 1/v e 1/[S], em vez
de v e [S], obtendo-se uma relação linear mais fácil de interpretar.
4
Equação de Lineweaver-Burk:
A partir desta equação e da sua representação
gráfica é possível retirar facilmente os valores de Km e
vmax:
Quando a reta corta o eixo das ordenadas
retira-se o valor de vmax:
Quando a reta corta o eixo das abcissas
retira-se o valor de Km:
A velocidade das reações é afetada por uma série de fatores, tais como a
temperatura e o pH do meio, ou a presença de ativadores ou inibidores.
A atividade enzimática tende a aumentar com a elevação da temperatura de forma
exponencial, até que se atinge um determinado valor de T a que a enzima desnatura. A relação
da velocidade com o pH é um pouco mais complexa, na medida que o pH do meio influencia
vários aspetos das enzimas, desde o seu estado de ionização à ionização dos aminoácidos do
centro ativo e, em casos extremos, à desnaturação. Cada enzima tem assim uma gama de
valores de T e pH para os quais a sua atividade é otimizada.
Ilustração 3 - Efeito da temperatura e do pH na atividade de uma enzima.
1.1.3 INIBIÇÃO
Inibidores são compostos que, ao se ligarem a uma enzima, reduzem a sua atividade
e a velocidade da reação catalisada. Os chamados inibidores reversíveis não provocam
alterações irreversíveis nas enzimas em que atuam.
Existem diversos tipos de inibidores que provocam a diminuição da velocidade da
reação atuando de modo diferente sobre a enzima:
Inibidores competitivos: são quimicamente semelhantes ao substrato e ligam-se ao
centro activo das enzimas impedindo a ligação enzima-substrato. Têm semelhanças
5
estruturais com o substrato
para se conseguirem associar
mas não reagem com a
enzima e, portanto, não dão
origem a nenhum produto.
Uma inibição deste tipo
diminui à medida que se
aumenta a concentração de
Ilustração 4 - Inibidores competitivos.
substrato
–
para
concentrações mais elevadas é mais provável que a enzima se ligue ao substrato que
ao inibidor, mantendo-se assim o valor de vmax. Apenas Km é alterado, verificando-se o
seu aumento;
Ilustração 5 - Efeitos de um inibidor competitivo.
Inibidores não competitivos: ligamse a locais da enzima que não o seu
centro ativo antes ou depois da
formação do complexo ES, pelo que
podem formar-se três tipos de
complexos: ES, ESI (enzimasubstrato-inibidor) ou EI. Como
continuam a permitir a ligação do
substrato o valor de Km mantém-se
inalterado. No entanto, como
apenas o complexo ES é funcional
verifica-se a diminuição de vmax;
Ilustração 6 - Inibidores não competitivos.
6
Ilustração 7 - Efeitos de um inibidor não competitivo.
Inibidores anti-competitivos: ligamse a locais da enzima que não o seu
centro ativo apenas após a
formação do complexo ES. Há a
formação de dois complexos, ES e
ESI, sendo o complexo ES o único
com atividade catalítica. Como o
inibidor apenas se liga ao complexo
ES, à medida que a concentração de
substrato aumenta a inibição é mais
acentuada. Verifica-se a diminuição
do Km e de vmax na mesma proporção.
Ilustração 8 - Inibidores anti competitivos.
Ilustração 9 - Efeitos de um inibidor anti competitivo.
O modo mais eficaz de interromper uma via metabólica é deixar de sintetizar as
enzimas que nela intervêm. No entanto, apesar de eficiente, este método é lento e não pode
ser aplicado em todas as situações. Para interromper rapidamente uma via é mais eficiente
inibir as suas enzimas, nomeadamente as suas enzimas-chave. Estas enzimas catalisam uma
reação apenas no seu sentido direto ou inverso, ao contrário da maioria das enzimas de uma
via, que catalisam reações em ambos os sentidos. Às enzimas que têm maior efeito regulador
numa determinada via chamamos enzimas reguladoras.
7
A regulação da atividade das enzimas pode ser feita recorrendo-se a diversos
mecanismos:
A regulação alostérica permite controlar o nível de atividade de uma enzima através
de ligações reversíveis e não-covalentes de componentes reguladores, os chamados
efetores. Estes podem ser positivos ou negativos e atuam sobre o Km e Vmax. O
substrato, por exemplo, pode ser um efetor homotrópico (molécula ligante e
moduladora são a mesma – substrato) e levar a fenómenos de cooperatividade (a sua
presença aumenta a afinidade enzima-substrato e é caracterizado por uma cinética
sigmoidal); já o produto pode ser um efetor heterotrópico (molécula ligante diferente
da moduladora – substrato e produto, respetivamente) e atuar sobre as enzimas
iniciais de uma via metabólica – controlo por retroalimentação;
A regulação por modificação covalente consiste em adicionar ou remover grupos
fosfato, metil, adenil, uracil, entre outros, à enzima. A fosforilação é a forma mais
comum de regulação e dá-se principalmente em resíduos de serina (Ser), treonina
(Thr) e tirosina (Tyr). Dá-se com recurso a ATP e é catalisada por cinases, sendo a
desfosforilação catalisada por fosforilases. Dependo da enzima, a forma fosfatada
pode ser ativa ou inativa e a poli-fosforilação (fosforilação de diversos resíduos)
confere um caráter regulador muito preciso;
A indução ou repressão da síntese de enzimas permite variar a sua concentração e
estimular ou retardar uma via. É um mecanismo lento e está reservado para condições
fisiológicas não habituais, como o aumento dos níveis de insulina em resposta a uma
glicémia elevada.
A coordenação das respostas dos diversos órgãos e tecidos ao mesmo sinal que
permite a reação adequada do organismo como um todo é obtida por ação de hormonas.
Estas atuam apenas nos tecidos para os quais são específicas e têm uma ação quer ao nível da
expressão genética (inibindo ou estimulando a síntese de uma enzima), quer da atividade
enzimática (fosforilações e desfosforilações).
Evento regulador
Efector típico
Resultados
Inibição pelo substrato
Inibição pelo produto
Controlo alostérico
Modificação covalente
Síntese e degradação da
enzima
Substrato
Produto
Produto Final
Outra enzima
Hormona ou
metabolito
Altera Vo
Altera Km e/ou Vmax
Altera Km e/ou Vmax
Altera Km e/ou Vmax
Altera a quantidade da
enzima
Tempo necessário
para a alteração
Imediato
Imediato
Imediato
Imediato a minutos
Horas a dias
Tabela 1 - Tipos de regulação enzimática.
As estratégias de regulação já mencionadas fazem parte de mecanismos de controlo
do organismo e constituem processos, na grande maioria das vezes, reversíveis. Em
8
farmocologia, por outro lado, induzem-se frequentemente modificações irreversíveis nos
reagentes ou enzimas.
As interações entre grupos do centro ativo de uma enzima e um reagente ditam a
reatividade do sistema, estando a especificidade enzima-substrato associada a uma base
molecular. Deste modo, a modificação de grupos nos reagentes ou a
alteração/adição/remoção de uma ligação pode influenciar a correta associação ou dissociação
do substrato. Por exemplo, se uma modificação no substrato levar a que este estabeleça uma
ligação covalente forte quando se encontra no centro ativo da enzima, então a dissociação do
complexo ES pode ser impedida e a enzima deixa de estar funcional, ficando inibida
irreversivelmente.
1.2
1ª AULA TEÓRICO PRATICA – ENZIMOLOGIA
1. Considere a seguinte interconversão metabólica que ocorre na glicólise:
Frutose-6-fosfato Glicose-6-fosfato K'eq = 1,97
a)
Calcule ∆G°' (em kJ mol-1) para esta reação, assumindo uma temperatura de
25ºC.
Aplicando a fórmula:
Obtém-se
b) Se as concentrações de frutose-6-fosfato e glicose-6-fosfato forem de 1,5 M e
0,5 M, respetivamente, qual será o valor de ∆G?
Novamente pela fórmula:
Obtendo-se
(Reação favorável de ocorrer no sentido direto)
c) Porque são ∆G°' e ∆G diferentes?
1. Condições de equilíbrio em termodinâmica: 25°C, 1 atm, concentração de produtos e
reagentes iniciais de 1 molar;
2. Em ∆G°' as concentrações são todas de 1 molar, menos a quantidade de hidrogeniões
que é de 10-7 e o pH é, portanto, 7.
3. Nesta reação temos produtos e reagentes: H3O+, H-, e a solução teria pH=0, pois havia
1M de hidrogeniões (=100M pH=0)
9
Outras considerações:
1. Se ∆G<0 então vai haver formação de produtos porque a reação é favorável pois a
energia de Gibbs vai baixar e consequentemente o sistema vai ficar mais estável
(aumenta a entropia e diminui a entalpia [energia interna do sistema]).
2. Para aumentar a entalpia do sistema temos de realizar trabalho sobre o mesmo, ∆G>0.
3. Pela seguinte equação também se pode verificar como ∆G°' e ∆G se relacionam:
=
Frutose-6-fosfato Glicose-6-fosfato (reação de gluconeogenese)
As enzimas não alteram o facto de a reação ser favorável ou não. Vão alterar a
velocidade com que esta ocorre.
Regulação de vias metabólicas:
Inibição ou ativação de enzimas
Regulação covalente
Regulação alostérica
Regulação competitiva/ não competitiva
Regulação genética
Podemos aumentar a concentração do reagente
Podemos diminuir a concentração de produto
Através da reação termodinamicamente desfavorável, o que acontece é que o destino
metabólico da glicose é: fígado (armazena sob a forma de glicogénio, não se quer que vá
para a glicólise).
No fígado, quando os reservatórios de glicogénio estão cheios, vai usar-se então a
glicólise.
2. Determine a concentração mínima de malato necessária para que a reação
catalisada pela fumarase (Malato Fumarato + H2O) ocorra no sentido direto,
a pH 7,0 e 25°C, se a concentração de fumarato for de 1 mM.
∆G<0
3. A reação catalisada pela aldolase tem um
G0' = 5,7 Kcal/mol. Qual o
mecanismo utilizado pelas células pera direcionar a recção no sentido da
clivagem aldólica?
A reação passa a ocorrer caso se verifique uma quantidade superior de reagente em
relação ao produto;
Na presença de muito produto G0'>0;
Na presença de muito reagente G0'<0.
10
4. Diga de que forma a presença de uma enzima altera as características
termodinâmicas de uma reação.
Baixam a energia do estado de transição, diminuindo a energia de activação
necessária a uma reação - aceleram a sua velocidade (velocidade até 1016x superior!);
5. Explique o significado reacional de estado de equilíbrio e de estado estacionário
da reação de transformação do substrato S em produto P na presença de uma
enzima.
Constantes:
Velocidade máxima
Afinidade substrato com a enzima (quanto mais baixo for Km, maior será a afinidade)
Cálculo:
Condicionantes:
K2 0 (Não há formação de produto)
Fase inicial (Km declive no ponto zero – Estado de equilíbrio)
No estado estacionário complexo ES mantem-se constante e por isso,
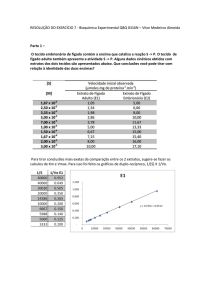
6. A partir da Tabela 1A, represente graficamente a variação da velocidade inicial
(Vo) da reação em função da concentração de substrato [S] na situação (a).
11
7. A partir da Tabela 1B, represente graficamente a linearização de LineweaverBurk para estimar os valores de Vmax e KM para as situações experimentais
(a), (b) e (c).
12
8. Atendendo aos gráficos obtidos e aos valores de Vmax e KM estimados,
caracterize o tipo de inibição em causa nas situações (b) e (c).
Para as rectas de ajuste,
Desprezando as diferenças entre
:
e
e
e entre
e
por não
serem significativas, conclui-se que em b há inibição competitiva (mesma Vmax e maior Km) e
em c há inibição não competitiva (mesmo Km e menor Vmax).
9. Faça uma representação gráfica hipotética, da variação da velocidade inicial
em função da concentração de [S] para a mesma enzima E, a uma temperatura
de 37ºC, que é a temperatura óptima da enzima E.
(Consultar gráfico na parte teórica)
13
10. A desidrogenase lática (LDH) é uma enzima expressa nos organismos
vertebrados sob a forma de 5 isoenzimas (Tabela 2), as quais se podem separar
por electroforese (Figura 1), tendo utilidade clínica no diagnóstico diferencial de
determinadas patologias. Sabendo que o perfil electroforético B corresponde a
um indivíduo saudável, qual o perfil electroforético correspondente a um
doente com enfarte agudo do miocárdio? Justifique.
Para manter a glicose é preciso livrar o NADH convertendo piruvato em lactato,
gastando NADH;
O coração quase não consome glicose, capta lactato que transforma em piruvato e faz
com que o piruvato entre no ciclo de krebs, por isso também usa a desidrogenase
láctica;
A, C doença lesão numa célula células morrem e libertam a enzima;
Ou pode ter sido erro na colheita. Esta pode ter sido efetuada muito rapidamente
havendo por isso destruição de células.
14