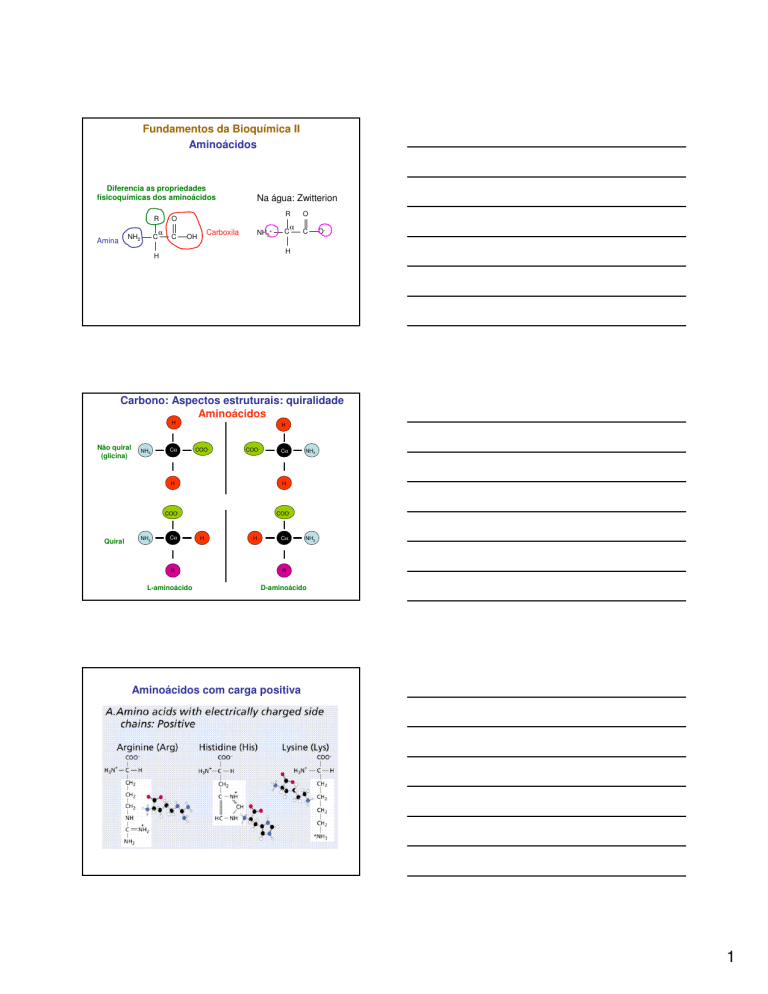
Fundamentos da Bioquímica II
Aminoácidos
Diferencia as propriedades
físicoquímicas dos aminoácidos
R
NH2
Amina
C
α
Na água: Zwitterion
R
O
C
Carboxila
OH
NH3+
C
α
O
C
O-
H
H
Carbono: Aspectos estruturais: quiralidade
Aminoácidos
H
Não quiral
(glicina)
Quiral
NH3
NH3
Cα
H
COO-
COO-
Cα
H
H
COO-
COO-
Cα
R
L-aminoácido
H
H
Cα
NH3
NH3
R
D-aminoácido
Aminoácidos com carga positiva
1
Aminoácidos com carga negativa
Aminoácidos polares sem carga elétrica
Aminoácidos com propriedades especiais
2
Aminoácidos hidrofóbicos
Aminoácidos hidrofóbicos
Aminoácidos: ligação peptídica
3
Peptídeos e Proteínas: Nomenclatura
Aminoácidos que formam parte de uma estrutura de um peptídeo ou de
uma proteína são denominados com terminação –il ao invés de –ina: alanil
(aminoácido ligado) ao invés de alanina (aminoácido livre)
Os átomos que formam a ligação peptídica são chamados de grupo
funcional peptídico
Proteínas e peptídeos possuem duas extremidades: a carboxi-terminal
(grupo COOH livre) e a amino-terminal (grupo NH2 livre).
A convenção determina que os peptídeos e as proteínas sejam
denominadas começando pela extremidade amino-terminal:
NH2-Gly-Ala-Trp-Phe-Cys-COOH
Peptídeos e Proteínas: Estrutura
Muitas proteínas incluem
componentes nãoproteicos na estrutura:
grupos prostéticos:
Cofatores
Oligossacarídeos
(glicoproteínas)
Lipídeos
(lipoproteínas)
Metais
(metaloproteínas)
Tamanho: 50 a 8000 AA
Peso molecular: 6000 a 1x106D,
a maioria possui menos que 2000AA (≤ 200.000D)
Estrutura Secundária: α-hélice
4
Estrutura Secundária: Folha β−pregueada
Desnaturação
Perda irreversível da estrutura espacial da
proteína, causada pelo calor ou por influência
química
Peptídeos e Proteínas: Função
Peptídeos e proteínas podem assumir uma grande variedade de
funções na célula:
Enzimas: proteínas catalíticas, que viabilizam reações químicas
com substratos e produtos nas condições físicoquímicas do
interior das células.
Transporte: catalisam a passagem específica e controlada de
compostos através das membranas da célula.
Armazenamento de nutrientes: alguns tecidos acumulam
proteínas como reservas de aminoácidos.
Sistemas de locomoção: garantem o funcionamento dos
mecanismos de deslocamento da célula ou do organismo.
Estruturais: garantem a estabilidade mecânica de formas
biológicas.
Defesa ou ataque.
Regulação metabólica: controlam a atividade de genes
Comunicação: estabelecem a comunicação com outros
organismos da mesma espécie ou com organismos de outras
espécies.
5
Enzimas: Proteínas catalíticas
Catalisadores bioquímicos de importância fundamental para a
vida. 99,99% das reações químicas da célula são catalisadas
por enzimas.
A grande maioria das enzimas são proteínas, raríssimas
reações são catalisadas por moléculas catalíticas de RNA.
Enzimas viabilizam reações químicas em condições brandas:
pH 7,0, solvente aquoso, temperatura ambiente, pressão
atmosférica.
6 classes
Oxidoredutases: reações de óxido-redução.
Transferases: transferência de grupos funcionais.
Hidrolases: reações de hidrólise.
Liases: eliminação de grupos funcionais para a formação de
ligações duplas.
Isomerases: reações de isomerização
Ligases: formação de ligações químicas acopladas à hidrólise
do ATP
Enzimas: Especifidade da Reação
Enzimas reagem com subtratos
específicos:
⇒ Especificidade estérica
⇒ Especificidade geométrica
Enzimas: Redução da energia de ativação
Enzimas reduzem a
energia de ativação
principalmente pela
estabilização do
estado de transição
TS: estado de transição
ES: complexo enzimasubstrato
EP: complexo enzimaproduto
6
Enzimas: Mecanismos de aumento da taxa de reação:
Efeitos de proximidade e orientação
Reações entre moléculas fisicamente ligadas a uma enzima aumentam
drasticamente a probabilidade de colisão, comparado à probabilidade de
colisão das mesmas moléculas em solução.
As moléculas que interagem não estão somente próximas umas das
outras nas enzimas, mas também orientadas de forma ótima para
viabilizar a reação.
Reação bimolecular,elevada
energia de ativação, taxa de
reação reduzida
Reação unimolecular, elevada
probabilidade de contato
acelera taxa de reação
Mobilidade reduzida dos
grupos químicos os mantém
em uma orientação relativa
ótima para a reação
Enzimas: Mecanismos de aumento da taxa de reação:
Estabilização do estado de transição
⇒Mecanismo mais importante de aceleração das taxas de reação
⇒ anticorpos catalíticos
Enzimas: Mecanismos de aumento da taxa de reação:
Induced Fit
⇒ Alteração da conformação da enzima após acoplamento do
substrato
Acoplamento de uma molécula de glicose à hexocinase:
exclusão de água
Glicose + ATP → Glicose-6-fosfato + ADP
7
Enzimas: Mecanismos de aumento da taxa de
reação:
Catálise eletrostática
Quando o substrato se liga na enzima, a água é geralmente
excluída do ponto de contato.
Isto reduz a constante dielétrica no ponto de contato entre o
substrato e a enzima, facilitando interações eletrostáticas entre a
enzima e o substrato
Protege os grupos funcionais da ação da água
Se a água participar da reação enzimática, o seu acesso ao sítio
ativo será controlado
Viabiliza a ação de grupos com caga elétrica da enzima na
interação
Enzimas: Mecanismos de reação - Ácido-base
⇒ Hidrólise de ligações ésteres
ou peptídicas, reações com
grupos de fosfato, adição de
grupos carbonila, etc.
⇒ A enzima evita a formação de
intermediários com carga
elétrica instáveis durante a
reação através da
disponibilização de grupos
funcionais com localização
apropriada para a
⇒ Doação de prótons (ácido)
⇒ Adsorção de prótons
(base)
⇒ Os prótons trocados entre o
substrato e a enzma serão
devolvidos à enzima no final da
reação
Grupos funcionais da proteína que catalisam reações ácido-base:
Imidazol (histidina), grupo amina α, grupo carboxila α, tiol da cisteína,
carboxilas R do glutamato e do aspartato, ε-amina da lisina, OH aromático da
tirosina, grupo guanidina da arginina
Enzimas: Catálise covalente
Intermediário da reação estabilizado por ligação covalente à
enzima
Os grupos R da histidina, asparagina, lisina, cisteína e serina
podem participar destas ligações atuando como nucleófilos
Modo principal de catálise das coenzimas piridoxal fosfato e
tiamina pirofosfato
8
Mecanismo químico da quimotripsina I
H
R2
N
H
4
3
Mecanismo químico da quimotripsina II
Enzimas: Participação dos aminoácidos na catálise
⇒ Somente uma proporção muito pequena dos aminoácidos de
enzimas participam da reação!
9
Enzimas: Catálise por íons metálicos
Íons metálicos atuam da seguinte maneira:
Garantir o acoplamento do substrato ao sítio ativo na orientação correta
Mediação de reações de óxido-redução
Estabilização de cargas eletrostáticas
Estabilização de cargas negativas
Metaloenzimas possuem íons de metais fortemente ligados: Fe+2, Fe+3, Cu+2 , Zn+2 , or
Mn+2
Enzimas ativadas por metais possuem íons metálicos acoplados por ligações fracas:
Na+, K+, Mg+2 , or Ca+2
Alguns grupos prostéticos são complexos orgânicos com íons metálicos: hemina
histidina
hemina
cisteína
Fe2S2
Enzimas: cofatores
Moléculas orgânicas, geralmente derivadas de vitaminas, que
auxiliam na catálise e são indispensáveis para a atividade
enzimática
⇒ Cada cofator catalisa uma classe específica de reações
⇒ cofatores podem ou não estar permanentemente ligados à enzima
⇒ Se ligam perto do sítio ativo
Coenzima A: Transferência de acilas (C2)
Vitamina: ácido pantotênico
⇒
Enzimas: cofatores
Cofatores de óxido-redução: Catalisam a transferência de elétrons
NADP (Nicotina-adenina-dinucleotídeo-fosfato)
NAD (Nicotina-adenina-dinucleotídeo)
Niacina ou vitamina B3
NAD(P)
(oxidado)
NAD(P)H2
(reduzido)
FAD (Flavina-adenina-dinucleotídeo)
Vitamina B2
FAD
(oxidado)
FADH2
(reduzido)
10
Enzimas: cofatores
Cofatores de transaminação: Catalisam a transferência de grupos amina
Piridoxalfosfato (vitamina B6)
Piridoxina
Piridoxamina
Piridoxal
Enzimas: cofatores
Cofatores de transcarboxilação:
Catalisam a transferência de grupos carboxila
Biotina (vitamina biotina)
Biotina
Biotina com grupo
carboxílico
Enzimas: cofatores
Cofatores de transferência de grupos C1:
Ácido tetrahidrofólico e derivados
Reações essenciais na síntese de serina,metionina, glicina, colina e
purinas
vitamina: ácido fólico:
Ácido tetrahidrofólico e derivados:
11
Enzimas: Efeito da temperatura e do pH na taxa de reação
Enzima
pH ótimo
Pepsina
Sucrase
Catalase
Arginase
Fosfatase alcalina
1,5
6,2
7,3
9,0
9,5
Cinética de Reações Enzimáticas – Lei de MichaelisMenten
E + S
k1
k-1
ES
k2
k-2
E+P
No início : P <<<< S
v0 = k2 [S]
v0: velocidade inicial de reação
Taxa de formação de ES: k1 ([Et] – [ES]) [S]
Et: concentração total da enzima
Taxa de destruição de ES: k-1[ES] + k2 [ES]
Cinética de Reações Enzimáticas – Lei de MichaelisMenten
Para condições de estado estacionário da
reação enzimática ([ES] constante):
k1 ([Et] – [ES]) [S] = k-1[ES] + k2 [ES]
k1 [Et] [S] – k1[ES]) [S] = (k-1+ k2) [ES]
[ES] =
KM =
k1 [Et] [S]
k1 [S] + k-1+ k2
k2 + k-1
k1
KM: constante de MichaelisMenten
12
Cinética de Reações Enzimáticas – Lei de MichaelisMenten
[ES] =
v0 =
v0 =
Vmax [S]
KM + [S]
[Et] [S]
KM + [S]
k2 [Et] [S]
KM + [S]
Equação de Michaelis-Menten
Cinética de Reações Enzimáticas – Significado do Km
Cinética de Reações Enzimáticas –
Constante catalítica Kcat
kcat =
Vmax
[Et]
Quando a enzima está saturada com substrato, kcat é
equivalente ao número total de moléculas do substrato
transformada por unidade de tempo por cada sítio ativo
⇒ Número de turnover
13
Cinética de Reações Enzimáticas –
Eficiência catalítica
EC =
Kcat
KM
Em condições fisiológicas, [S] < KM
EC é um indicador da eficiência catalítica de uma enzima
O limite superior do valor de EC é a taxa de difusão da molécula
na água (cerca de 109 M/s na água na temperatura ambiente
Enzima
Acetilcolinesterase
Anidrase carbônica
Catalase
Fumarase
Urease
Substrato
Kcat (s-1)
KM (M)
Kcat/KM (M-1s-1)
acetilcolina
CO2
HCO3H2O2
fumarato
malato
uréia
1,4x104
1x106
4x105
1x107
8x102
9x102
1x104
9x10-5
1,2x10-2
2,6x10-2
2,5x10-2
5x10-6
2,5x10-5
2,5x10-2
1,5x108
8,3x107
1,5x107
4X108
1,6x108
3,6x107
4x105
Cinética de Reações Enzimáticas –
Inibição da atividade enzimática
Inibição competitiva
Inibição não-competitiva
Inibição incompetitiva
14










