INJÚRIA RENAL AGUDA
Paulo R. Margotto/Márcia Pimentel de Castro
Capítulo do Livro Assistência ao Recém-Nascido de Risco. 3ª Edição, em
preparação
INTRODUÇÃO
A injúria renal aguda (IRA), definida como um súbito “déficit” da função renal,
resulta na retenção de produtos “tóxicos” do metabolismo corporal. No recém-nascido,
definimos IRA quando a creatinina sérica é igual ou superior a 1,5mg%, podendo ou não
ser oligúrica (débito urinário inferior a 0,5ml/kg/hora). Nos poucos relatos disponíveis
sobre sua incidência nesta faixa etária, a doença parece ocorrer em torno de 3% a 8% das
internações em UTI neonatais. Freqüentemente são bebês prematuros e/ou gravemente
enfermos.
O recém-nascido é mais suscetível à injúria renal aguda, provavelmente pelas
alterações volêmicas que ocorrem no período neonatal, pelo aumento das perdas insensíveis
e, no prematuro, deve-se considerar também a imaturidade do desenvolvimento do sistema
urinário, uma vez que a embriogênese renal termina por volta da 35ª semana gestacional.
A IRA está associada a causas multifatoriais, mas hipotensão, hipovolemia,
hipoxemia e septicemia são as mais comumente relacionadas com mecanismos pré-renais
(85%). Causas renais e condições pós-renais causadoras de IRA são muito mais raras, e
correspondem a 11% e 3% dos casos, respectivamente.
A doença caracteriza-se por alterações no equilíbrio hidreletrolítico e ácido básico,
descontrole hormonal, elevação da creatinina e uréia sangüíneas, oligúria, embora em
alguns casos possa haver poliúria desde o início do quadro. A IRA frequentemente está
vinculada a hiponatremia, hipercalemia, acidose metabólica e outras alterações metabólicas.
A hipervolemia pode ser significativa nos neonatos anúricos.
O diagnóstico no recém-nascido se faz por meio da creatinina sérica em ascensão
(0,2 - 0,3 mg%/ dia) ou >1,5mg%, geralmente associada a oligo-anúria (ausência de débito
urinário após 48 horas de vida ou débito urinário inferior a 0,5 ml/kg/hora). Vale lembrar
que 97% dos recém-nascidos (RN) urinam nas primeiras 24 horas de vida, e que 4% a 22%
dos RN apresentam a 1a. micção na sala de parto.
Na avaliação e condução do neonato com IRA é preciso considerar: história e exame
clínico cuidadoso, urinálise, avaliação hematológica, dosagem e/ou taxa de excreção de
sódio urinário (não fidedigna se obtida sob uso de agentes inotrópicos ou diuréticos),
ultrassonografia com Doppler de vias urinárias, eventualmente uretrocistografia miccional e
cintilografia radioisotópica. Uma vez firmado o diagnóstico, o tratamento deve ser
prontamente instituído, compreendendo o tratamento etiológico, restabelecimento do
equilíbrio hidreletrolítico, suporte nutricional e até dialítico, se necessário.
Diálise algumas vezes é inevitável e, embora seja um tratamento disponível quando
os demais recursos falham, trata-se de um procedimento tecnicamente difícil, sempre
complicado e que pode falhar. Prevenção e atenção especial aos fatores de risco devem ser
os objetivos, quando se trata de pacientes de alto risco.
Fatores relacionados com mortalidade incluem: falência de múltiplos órgãos,
hipotensão que exige uso de suporte inotrópico, instabilidade hemodinâmica e necessidade
de ventilação mecânica ou diálise. O prognóstico e recuperação da IRA são altamente
dependentes da doença de base, com excelente prognóstico da função renal quando a
condição clínica inicial for passível de tratamento.
É fundamental o contexto de uma UTI neonatal/pediátrica com “expertise” no
manuseio de neonatos gravemente enfermos, possibilitando toda complexa estrutura que se
faz necessária para recuperação desses pacientes.
O desafio do manuseio da IRA no neonato só pode conduzir ao êxito quando
consideramos um contexto multidisciplinar, com infra-estrutura hospitalar adequada,
conhecimento técnico, dedicação e respeito mútuo entre as equipes e para com o paciente e
seus familiares.
FUNÇÃO RENAL DO RECÉM-NASCIDO
Na vida intra-uterina, a placenta é o principal regulador da composição de líquidos;
a contribuição do rim na manutenção da homeostase é mínima, sendo apenas responsável
pela manutenção de um volume adequado de líquido amniótico.
Com o nascimento, o rim passa a atender às necessidades normais do recémnascido, sendo que suas funções se aperfeiçoam à medida que se processa o crescimento.
Frente às situações em que ocorre desequilíbrio da homeostase, conseqüente a
fatores patogênicos ou iatrogênicos, o rim pode não responder de forma adequada, como
acontece em crianças maiores e em adultos. Essas limitações refletem uma "imaturidade"
ainda observada nesse período. São elas:
- Taxa de filtração glomerular (TFG) baixa, secundária a uma resistência vascular
aumentada ao nível das artérias glomerulares. Enquanto 2% a 3% do débito cardíaco, vai
para os rins na vida intra-uterina (esses órgãos não têm a função de controlar o meio
interno, função esta desempenhada pela placenta), ao nascimento este percentual do débito
cardíaco como fluxo sanguíneo renal deve ser sextuplicado em poucos dias, atingindo 12%
a 18% no RN a termo, aproximando-se de 25% que é o nível de adultos. A taxa de filtração
glomerular é de aproximadamente 26ml/min/1.73 m² com 34 semanas de idade gestacional.
Com 25 semanas, a TFG é de 2 ml/min/1.73 m², alcançando níveis de maturação na idade
de 9-12 meses (aproximadamente 125 ml/min/1.73 m²). Podemos calcular a TFG pela
fórmula: K x comprimento do RN creatinina sérica (fórmula de Schwartz), sendo K uma
constante, cujo valor é 0.33 para RN de baixo peso e 0.45 para RN a termo (K representa a
creatinina urinária por unidade de peso corporal). Existe, então, limite da capacidade do RN
para resistir ao stress de uma sobrecarga de água.
- Desenvolvimento glomerular mais avançado que o tubular, resultando em
desequilíbrio glomérulo-tubular. Esta assertiva induz a um julgamento injusto: embora a
taxa de reabsorção tubular seja ainda pior do que a TFG, a função tubular de reabsorção ou
excreção por superfície quadrada de túbulos é melhor do que a função glomerular
propriamente dita. Existem poucos túbulos e estes são pequenos; a nefrogênese que se dá de
modo centrífugo (da pelve para o córtex) só se completa na 34ª semana. Os primeiros
néfrons a surgir são os justa-medulares, que têm o glomérulo no córtex ou próximo à
medula, cuja alça de Henle é profunda (atinge a medula) e representam 15% da população
total de néfrons na vida adulta. Estes são os mais eficientes para a manutenção do meio
interno. Os outros 85% dos néfrons são corticais, menos eficazes (têm a alça de Henle mais
curta) e surgem por volta da 34ª semana de gestação. Assim sendo, não é justo afirmar que
os RN têm uma imaturidade tubular tão exagerada quando comparada com a função
glomerular; a superfície dos túbulos é pequena, de modo que a função final fica diminuída.
- Deficiente concentração: incapacidade de alcançar níveis de osmolaridade
urinária acima de 700 mOsm/1. Os túbulos têm uma capacidade limitada de concentrar e
de diluir urina, e esta capacidade freqüentemente é agredida por situações relacionadas a
outras enfermidades que o RN apresenta, especialmente a hipóxia, quando a reabsorção de
Na+ do ultrafiltrado, que consome energia, fica extremamente prejudicada, em decorrência
do processo oxidativo comprometido.Há imaturidade morfológica da alça de Henle e
disponibilidade limitada de uréia nesta faixa etária.
- Limitada habilidade de diluir frente a uma sobrecarga de água.
Limitação da taxa de excreção de água resulta de uma limitada taxa de filtração
glomerular (TFG). Condições em que o líquido do espaço extra celular está aumentado,
como nas situações de excesso de hormônio anti-diurético ou situações que associam-se à
secreção inapropriada de hormônio anti-diurético (meningite, asfixia e hemorragia intra
ventricular, entre outras), provocam aumento de peso, diminuição da diurese e aumento da
densidade urinária (para mais informações sobre SSIHAD: consulte o capítulo de
Hidratação Venosa).
- Baixa capacidade de tampão do rim: concentrações baixas de bicarbonato
sanguíneo.
HOMEOSTASE DO SÓDIO
Recém-nascidos de termo tendem a manter um balanço positivo de sódio, devido a
uma forte tendência de reabsorver o sódio filtrado. Frente a uma sobrecarga de sódio,
apresentam taxa de excreção limitada do soluto, com risco de hipernatremia. A habilidade
máxima do RN a termo excretar sódio está em torno de 12 mEq/kg/dia de Na+.
Em recém-nascidos pré-termo, no período de 2 - 5 semanas de vida, observa-se
uma inadequada reabsorção tubular de sódio, provocando uma resposta natriurética (a
hiponatremia é mais severa entre a 2ª e 3ª semanas de vida). A hipernatremia pode ser
observada em duas situações especiais: perdas renais aumentadas de água (diurese osmótica
– vale lembrar os efeitos da hiperglicemia) ou perdas insensíveis aumentadas. Neste último
caso, a hipernatremia ocorre com o espaço extracelular normal ou levemente diminuído.
Sinais / sintomas: perda de peso acentuada, tendência à hipotensão, com densidade urinária
aumentada, aumento da frequência cardíaca, diurese diminuída e algum grau de acidose
metabólica. Esta é a situação mais comum nas Unidades de Cuidados Intensivos Neonatais,
em virtude da pouca valorização que se costuma dar às perdas insensíveis através da pele
(imaturidade dos extratos córneos). É preciso lembrar que um RN pré-termo tem
aproximadamente 85% a 90% de seu peso corporal representado por água, enquanto que no
RN a termo esta proporção cai para 75% e no lactente de 3 meses é de aproximadamente
60%.
HOMEOSTASE DO POTÁSSIO
Recém-nascidos muito baixo peso: apresentam balanço positivo de K+ durante
todo o período neonatal. O risco de hipercalemia é grande, mesmo na ausência de oligúria,
devendo a calemia ser monitorizada precocemente. Hipercalemia não oligúrica tem sido
relatada em 50% nestes RN na primeira semana de vida, secundária a deficiência da Na-K+
ATPase e ao grande desvio de K
para o extracelular. Mais recentemente tem sido
atribuída ao baixo fluxo na veia cava superior (reflexo da redução do fluxo sanguíneo
sistêmico e, consequentemente, da taxa de filtração glomerular)
-
Papel da Aldosterona
Níveis elevados de aldosterona são insuficientes para promover a absorção
adequada do excesso de sódio que chega ao túbulo distal, que deixou de ser reabsorvido em
segmentos anteriores do néfron. Desta forma, o RN se torna incapaz de manter o balanço do
íon. Altas concentrações plasmáticas de aldosterona podem refletir uma compensação
fisiológica para menor resposta dos túbulos renais a este hormônio (a partir da 3ª semana de
vida, os túbulos renais respondem bem a aldosterona).
FISIOPATOLOGIA:
Várias teorias apontam uma combinação de mecanismos atuando na gênese da IRA:
1- vasoconstrição renal:
O evento fisiopatológico final comum que resulta na IRA é uma nefropatia
vasomotora, que leva a Necrose Tubular Aguda (NTA) e IRA estabelecida. A
nefropatia vasomotora pode ser descrita como uma intensa vasoconstrição das
arteríolas aferentes e eferentes, e parece ser o evento dominante na patogênese da IRA
no período neonatal, resultando em diminuição da filtração glomerrular e oligoanúria.
Um fluxo sanguíneo renal menor acarretaria lesões às células epiteliais tubulares,
resultando em um aumento na concentração do sódio no fluído que chega à mácula densa.
Uma quantidade maior de soluto no túbulo distal estimularia a liberação de componentes
vasoativos do aparelho justaglomerular (ativação do sistema renina-angiotensina).
A angiotensina II, ativada pela renina, provocaria vasoconstricção da arteríola
pré-glomerular, com aumento da resistência vascular cortical e diminuição da TFG .
Esse "feed-back" túbulo glomerular conservador de água e eletrólitos tem a
desvantagem de ser não seletivo, retendo também, catabólitos nitrogenados e outras
substâncias. À medida que acontece a recuperação gradual tubular, melhora a absorção de
sódio, desestimulando progressivamente o mecanismo compensador.
Estudos recentes têm investigado o papel da adenosina como potente
vasoconstrictor renal, razão pela qual a teofilina, um antagonista da adenosina, pode
prevenir a IRA induzida pela hipoxemia.
2- Fatores relacionados ao Néfron:
a) A lesão do túbulo proximal poderia levar à necrose das células epiteliais, que
seriam eliminadas para dentro da luz tubular e ficariam impactadas causando obstrução
principalmente na curva da alça de Henle. A obstrução causaria aumento da pressão no
espaço de Bowman, e aboliria completamente a formação do filtrado.
b) Segundo fator relacionado ao néfron seria a perda retrógrada do filtrado
glomerular (tubular "backleak"). A perda da integridade estrutural tubular, com exposição
da membrana basal, o tornaria permeável a substâncias que normalmente não penetrariam
pela membrana , como inulina e creatinina, além de fluidos e solutos acumulados no ultra
filtrado que passariam para o interstício renal e, eventualmente, para o plasma.
CAUSAS DA INSUFICIÊNCIA RENAL AGUDA
- Insuficiência pré-renal: ocorre quando se instala fluxo sangüíneo renal
insuficiente. Não havendo lesão renal, a reversibilidade do processo dependerá da correção
hemodinâmica, pois a persistência da condição anormal poderá significar causa importante
da IRA intrínseca.
- Insuficiência renal: implica em lesão do parênquima renal. Inclui causas
congênitas e adquiridas. A NTA pode derivar de lesão anóxica e/ou isquêmica ou de
nefrotoxinas.
- Insuficiência pós-renal: Incomum. Ocorre por obstrução do fluxo urinário depois
de formada a urina e, para que resulte em oligúria, deve afetar ambos os ureteres, bexiga ou
uretra. Resultam de malformações congênitas ou pressões extrínsecas, como tumores,
hidronefrose e válvula de uretra posterior; bexiga neurogênica, estenose da junção
ureteropélvica bilateral.
Quadro 1 Principais causas de Insuficiência Renal no Neonato*
Pré- renais
Obstrução pós-renal
Insuficiência renal intrínseca
Hipotensão causada por:
Obstrução ureteral
Anomalias congênitas
-Choque séptico
-válvula de uretra
-displasia cística
-Hemorragia materna
posterior
-hipoplasia
anteparto
-imperfuração
-agenesia
-Hemorragia gêmeo a
prepucial
-rins policísticos
gêmeo
-estreitamento
Inflamatórias
-Hemorragia neonatal
uretral
-sífilis ou toxoplasmose
-Cirurgia cardíaca
-divertículo uretral
-congênitas
-Insuficiência
cardíaca
-megauretra
-pielonefrite
congestiva
-ureterocele
Vasculares
-Asfixia perinatal
-obstrução
-trombose venosa
-Desidratação
ureteropélvica ou
-necrose cortical
ureterovesical
-trombose arterial
Tumores
extrínsecos
-CID
comprimindo a saída da Necrose Tubular Aguda
bexiga
-asfixia perinatal
Bexiga neurogênica
-desidratação
-choque
-nefrotoxinas
* Segundo Rahman, N. , Boinear, F. G. e Lewy, J. E.: Renal failure in the perinatal period.
Clin Perinatol 8: 241, 1981.
A asfixia perinatal é a causa mais comum de IRA intrínseca no RN, podendo também ser
pré-renal, uma vez que a asfixia contribui com a hipoperfusão renal, além de ocorrer um
desvio de sangue dos rins para melhorar a circulação ao nível de coração e cérebro. Estudos
recentes demonstraram que falência renal, definida por aumento de nível de creatinina
sérica, tem uma prevalência de 61% em associação com severa asfixia em RN a termo e,
neste caso, encontramos predominantemente IRA não oligúrica. Uma vez que RN a termo
sadios apresentam valores de creatinina sérica de 0,89mg%, (+- 0,02 mg%) no primeiro dia
de vida e 0,50 mg% (+- 0,02 mg%) a partir do 5o dia, IRA pode ser definida como níveis
de creatinina sérica superiores a 1,5mg% associado com uma função renal materna
normal.(deve-se determinar o nível de creatinina sérica materna na hora do parto). IRA não
oligúrica pode ser definida como débito urinário maior que 1ml/kg/h depois do primeiro
dia de vida. Em casos de asfixia, os autores observaram a presença de IRA não oligúrica em
61% dos RN a termo que sofreram asfixia grave; IRA oligúrica, em 25% e anúrica em
menos de 15%. Foi proposto um escore de morbidade, capaz de determinar, com uma hora
de vida, a probabilidade do RN desenvolver falência renal com 100% de sensibilidade e
72% de especificidade. Este escore baseia-se na escala de Apgar no 5o minuto (menor que
6) e valor do déficit de base (aferido através da gasometria arterial) na 1a hora de vida
(menor que 10).Taxas de filtração glomerular persistentemente baixas e disfunção tubular
têm sido relatadas em 40% dos sobreviventes de insuficiência renal aguda no período
neonatal, na ausência de malformações do trato genitourinário.
Quanto a nefrotoxicidade dos antibióticos, estima-se que 10 a 30% dos pacientes em
uso de aminoglicosídeos apresentam IRA transitória, geralmente de natureza não oligúrica.
DIAGNÓSTICO:
-História clínica: deve dar enfoque a condições clínicas que potencialmente podem
levar a dano renal. Suspeitar de oligúria nos RN com ausência de diurese nas primeiras 24
horas (93% urinam dentro deste período, débito urinário < 15 a 20 ml/kg/24h).
- Exame Físico: investigar estado de hidratação, jato urinário, sinais de choque ou
hipovolemia, pressão arterial eem
mm
meem
mbbrrooss ssuuppeerriioorreess ee iinnffeerriioorreess, pulsos, pressão venosa
central, freqüência cardíaca.
Massas tumorais na região do flanco e hipogástrio, malformações da parede
abdominal. Anormalidade do trato urinário inferior.
- Exames laboratoriais:
a) sangue:
Sódio e Potássio: pode ocorrer hiponatremia dilucional ou por disfunção tubular
e/ou hipercalemia;
Uréia e creatinina:
São produzidas endogenamente e excretadas na urina primariamente por filtração
glomerular. A uréia é produzida no fígado como produto final do ciclo ornitina-argininauréia e novamente é reabsorvida a nível tubular na proporção de 30% da concentração
filtrada. A creatinina é produto final da degradação da creatina encontrada no músculo
esquelético sendo, portanto, proporcional à massa muscular. A excreção por filtração é
igual à produção, mantendo-se constante o nível sérico.
Ao nascimento refletem os valores maternos, até por volta de 48 horas de vida. Na
IRA a uréia está em níveis superiores a 28 mg%, e a creatinina acima de 1 mg% (níveis
médios normais de creatinina: 0,75 mg% e a partir dos 7 dias de vida: 0,68 mg%: nos RN
abaixo de 29 semanas e peso <1000g, existe um retardo do decréscimo da creatinina sérica,
em relação aos RN de 29 a 32 semanas que se estende até por volta do 6º dia de vida,
segundo Auron e MJ Mhanna).
Alguns fatores podem determinar o aumento de uréia: dieta rica em proteínas,
oferta aumentada de proteínas na Nutrição Parenteral Total (NPT), hemorragia
gastrintestinal e desidratação, por exemplo. Portanto, não é o melhor indicador para avaliar
a função renal. A creatinina expressa a função tubular, uma vez que é secretada pelo túbulo
e não mais reabsorvida. O aumento de creatinina da ordem de 0,5mg/dl/dia indica uma
redução severa da TFG. Quando a creatinina sérica dobra, a TFG cai 50%.Quando a relação
uréia/creatinina é maior que 20, deve-se suspeitar de um aumento da produção de uréia ou
aumento de sua reabsorção a nível tubular. Condições que resultam em diminuição do
volume intravascular acarretam um aumento da reabsorção tubular de água e de uréia, sem
alteração significativa da função glomerular.
Hemocultura: pesquisar infecção;
Gasometria: acidose metabólica;
Hipocalcemia, Hiperfosfatemia e hipomagnesemia.
b) Urina:
Densidade urinária: normal 1005 – 1010; valores acima destes são considerados
anormais. (multiplicando-se os dois últimos números da densidade urinária por 30 pode-se
calcular a osmolaridade urinária: ex: DU = 1010; Osmolaridade urinária = 1030).
Osmolaridade urinária máxima: RN pré-termo = 600 mOsm/l; RN a termo = 800 mOsm/l;
adulto = 1.200 mOsm/l.
Na IRA pré-renal a urina é hipertônica e relativamente isenta de Na+ (U Na < 20
mEq/l). A intensa avidez por Na+ e a função tubular ainda preservada, resultam em
reabsorção de 99% do Na+ filtrado. Além disso, o baixo fluxo renal condiciona a reabsorção
da uréia filtrada, mas não da creatinina, resultando num aumento desproporcional da uréia
em relação a creatinina sérica (BUN /P creat > 10).
Na lesão parenquimatosa, a concentração de Na+ urinário tende a ser elevada (U Na
> 40 mEq/l), a capacidade de concentrar urina e excretar creatinina está diminuída e a
reabsorção preferencial de uréia está perdida.
A excreção fracionada de Na+ (EFNa ) figura com o melhor teste para avaliar lesão
renal propriamente dita. Na IRA renal a EF Na é quantitativamente superior a 1% e,
freqüentemente, tão alta quanto 2 a 5%. Na IRA pré-renal a EF Na < 1%.
UNa
Pcr
EF Na
=
____ X ______ X 100
U cr
PNa
Onde: U Na = sódio urinário
Pcr = creatinina plasmática
Ucr = cretainina urinária
P Na = sódio plasmático
Para os RN com menos de 31-32 semanas, valores maiores da EF
proposto (5%), tornando difícil a interpretação do ENaF nestes RN com IRA
Na,
tem sido
Sedimento urinário: presença de hematúria, cilindros, leucocitúria, indicam lesão renal;
Uréia, creatinina, sódio e potássio urinários.
c) ECG: Alterações observadas na hiperpotassemia.
d) Ultra-sonografia: Avaliação de massas renais e alterações morfológicas na
estrutura do parênquima renal.
e) Urografia excretora: Pouco utilizado - risco de maior toxicidade do contraste.
contraste.
f) Biópsia renal
g) Cintilografia radioisotópica
DIAGNÓSTICO DIFERENCIAL:
Diante de um paciente com oligúria e azotemia, torna-se importante a distinção
entre IRA pré-renal e renal propriamente dita, pois a abordagem terapêutica será diferente.
Testes diagnósticos para a diferenciação:
- suspeita clínica de depleção de volume: administrar solução fisiológica ou plasma, num
volume de 20ml/Kg durante 60 a 20 min; ppooddeennddoo--ssee cchheeggaarr aattéé 4400 m
mll//kkgg.. Se persistir
oligúria :- furosemide 2mg/Kg/dose; se não houver diurese (> 2 ml/Kg/hora), após 60-120
min = IRA intrínseca). Atualmente dá-se preferência à solução de cristalóide.
- Relação uréia plasmática/creatinina plasmática
IRA pré-renal (aproximadamente 85% dos casos): aumento desproporcional da
uréia em relação a creatinina . Proporção > 10:1.
IRA renal intrínseca (aproximadamente 11% dos casos): aumento proporcional
de uréia e creatinina. Proporção <10:1
IRA pós-renal: menos de 5% dos casos.
- Osmolaridade urinária (mOsml/l): IRA pré-renal > 400 e IRA intrínseca: < 400
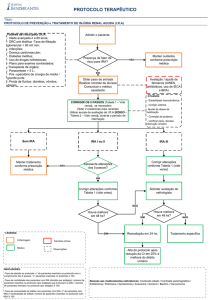
TRATAMENTO
Uma vez diagnosticada a IRA, torna-se necessário uma monitorização cuidadosa
para prevenir ou tratar precocemente as complicações.
Tratamento Geral:
1- Administração de líquidos e eletrólitos:
A reposição de volume deverá se limitar às perdas insensíveis e às perdas de
fluído externo (urina, SOG, drenos). Deverá ser subtraída a água endógena diária produzida
pelo metabolismo (9ml/Kg/peso). As perdas insensíveis/24 horas variam com o peso de
nascimento e, nos 3 primeiros dias, são da ordem de:
700-1000g: 82ml/kg
1001-1250g: 56ml/kg
1251-1500g: 46ml/kg
> 1500g: 26ml/kg
Em uso de fototerapia ou calor irradiante, acrescentar 20 ml/Kg/dia.
A criança deverá perder de 0,5 a 1% de peso por dia, por catabolismo tecidual.
Na fase de oligúria a administração de eletrólitos limitar-se-á a proporção de
eletrólitos previstos para o volume das perdas extra-renais calculadas. A hiponatremia
durante a fase de manejo da IRA oligúrica indica superestimativa das perdas e deve ser
tratada com restrição hídrica mais rígida. A concentração de Na+ sérico deverá ser mantida
entre 135 – 145 mEq/l. A administração de Na+ só será feita quando ocorrer hiponatremia
acentuada (Na+ < 120 mEq/l) ou quando houver sintomatologia clinica (torpor, convulsões).
Neste caso, pode ser indicada a administração de sódio hipertônico (solução a 3%). Na fase
de poliúria será baseada no balanço hídrico diário e controle laboratorial seriado.
2- manutenção da temperatura: manter zona de temperatura neutra
3- Dietético:
O paciente com IRA é freqüentemente hipermetabólico e evolui para desnutrição
aguda. O catabolismo acentuado leva a instalação acelerada de uremia, hiperpotassemia e
acidose, antecipando a necessidade de tratamento dialítico. Ingesta calórica deve ser, no
mínimo 100 cal/kg /dia e o aporte protéico aproximado de 1g/kg/dia. Os pacientes em
diálise não toleram a via digestiva devido ao aumento da pressão intra-abdominal.
Dar preferência sempre ao Leite Materno;
Nutrição Parenteral Total: encontra-se no mercado produto com formulação especial
de aminoácidos.
4. Manutenção da pressão arterial:
Expansão volumétrica (já descrita anteriormente)
Uso de drogas vasoativas: indicadas quando se tem certeza de que não há depleção
de volume circulante, e o paciente se mantém- hipotenso. Deve-se procurar manter uma PA
aceitável, a fim de garantir uma pressão de perfusão adequada em nível de artérias renais,
possibilitando e favorecendo a filtração glomerular.
Dopamina: Estimula receptores e dopaminérgicos. O mito de que
baixas doses de dopamina causam vasodilatação renal seletiva, doses médias causam
vasodilatação geral e aumentam o inotropismo e altas doses causam vasoconstricção precisa
ser desmentido. Esta informação deriva de cães adultos e sadios e não podem ser
generalizadas para RN criticamente doentes. Para receptores a dopamina é 30 a 40 X
menos potente que a epinefrina ou a norepinefrina. Possui farmacocinética muito variável
no RN.No entanto a taquicardia pode ser significante e problemática, uma vez que diminui
o tempo diastólico e, conseqüentemente, o enchimento coronário. Além disso, a dopamina
estimula receptores do seio carotídeo, levando a uma diminuição da ventilação e da
dinâmica ventilatória. Estudos randomizados têm demonstrado que o aumento da PA com o
uso da dopa é freqüentemente acompanhado por uma diminuição da fração de ejeção do VE
(aumento da pós-carga), uma diminuição ou nenhum efeito sobre o débito do VD e fluxo na
Veia Cava Superior, nenhum aumento da contratilidade cardíaca ou na perfusão cerebral. O
principal mecanismo de ação sobre a PA parece ser a vasoconstricção (efeitos e.
Dose: 5 – 15 mcg/kg/min. Apresentação: frascos 5 mg/ml.
Dobutamina: Sintetizada com o intuito de se criar um 1 agonista seletivo. É um
efetivo agente inotrópico, que causa também vasodilatação e moderada taquicardia. Em
doses muito elevadas pode aumentar a PA e provocar um aumento da resistência vascular
sistêmica. Possui poucos efeitos tóxicos, sendo a taquicardia o principal evento observado
em lactentes jovens, mas pode ser facilmente revertida com a redução da dose. Em
pacientes com choque cardiogênico, ela aumenta o débito cardíaco, diminui a pressão
capilar pulmonar e a resistência vascular sistêmica. Dobutamina é mais efetiva em aumentar
a perfusão sistêmica que a dopamina, mas não a PA. O tratamento da IRA secundária ao
choque, na ausência de hipotensão, deve ser visto sob uma abordagem fisiopatológica, e
direcionado para o aumento do Débito Cardíaco (DC) e diminuição da resistência vascular
sistêmica e pulmonar. Com isso, sugerimos dar preferência a dobutamina, com baixas doses
de epinefrina, como uma alternativa razoável. Deve ser avaliado o seu uso após
identificação da causa da IRA (baixa perfusão renal secundária a falência de bomba
cardíaca). Dose: 5 a 20 micrograma/kg/minuto. Apresentação: frascos 12,5 mg/ml.
Epinefrina (consulte o capítulo de Choque Séptico): é uma catecolamina potente
que age mais diretamente nos receptores adrenérgicos do que através da liberação de
norepinefrina armazenada. Estimula os receptores eTem ação relacionada
à dose. Causa vasodilatação em doses muito baixas; o efeito inotrópico aumenta conforme a
dose aumenta, e começa a causar vasoconstricção importante em altas doses. Neste caso, a
vasoconstricção se sobrepõe ao efeito inotrópico positivo e o débito cardíaco começa a cair.
Então: baixas doses aumentam o DC; doses moderadas aumentam a PA e doses muito altas
podem diminuir o DC. A infusão de doses baixas (menos que 0,3 microgramas/kg/minuto)
está primariamente associada com efeitos beta adrenérgicos, incluindo: aumento da
contratilidade cardíaca, freqüência cardíaca, pressão de pulso e pressão sanguínea sistólica.
Em doses maiores que 0,3 microgramas/kg/minuto, os efeitos adrenérgicos predominam,
produzindo aumento da pressão sistólica e diastólica e diminuição da pressão de pulso.
Toxicidade: age diretamente no metabolismo do lactato, causando um aumento em sua
produção, levando a um aumento na concentração sérica de lactato. Está indicada em casos
de choque com hipotensão, em na presença de sinais de perfusão ruim em pacientes
com volume intravascular adequado e ritmo estável, e na bradicardia com
repercussão hemodinâmica. Deve ser administrada em cateter venoso central, com equipo
fotoprotetor, para garantir uma via segura de administração e minimizar o risco de
extravasamento. Como a adrenalina tem uma meia vida curta (2 minutos), a infusão deve
ser ajustada a cada 5 minutos, até ser alcançado o efeito clínico desejado. Dose: 0,1 a 1
micrograma/kg/minuto. Apresentação: frascos 1 mg/ml (1:1000).
Norepinefrina: não foi muito estudada em modelos neonatais, devido a sua menor
afinidade por receptores Muito provavelmente, causa mais vasoconstricção do que a
epinefrina; por esta razão, tem sido amplamente usada em adultos com sepse por Gramnegativo e choque quente, nos quais parece melhorar a oferta de O2 aos tecidos e o débito
urinário. Uma vez que choque séptico acompanhado por vasodilatação (choque quente) não
é comumente visto em RN, norepinefrina provavelmente tem um papel limitado.
Inotrópico não catecol / agentes pressores: Agentes que bloqueiam a ação da
fosfodiesterase III têm sido usados em adultos e crianças mais velhas, com algum efeito.
Estas drogas, aumentam o AMPc intracelular, o que leva a um efeito inotrópico e
vasodilatação. (Consultem o Capítulo de Hipotensão Pulmonar Persistente).Em modelos
mamíferos neonatais a PDE III tem efeitos mínimos ou nenhum efeito, e até mesmo efeito
inotrópico negativo. As conseqüências sobre o miocárdio dos RN PT são desconhecidos e
não podem ser previstas a partir de estudos em animais. Milrinona pode ter outros efeitos
adversos: lesões musculares podem ser vistas sempre que o trabalho cardíaco está
aumentado, e isto pode exceder qualquer oferta de O2 ou substrato ao músculo cardíaco.
Choque séptico: é uma das causas mais freqüentes de choque no RN, que pode, entre outros
fatores, levar a um quadro de IRA. Além do tratamento preconizado do choque (consulte o
capítulo de Choque Séptico), alguns autores citam o uso de corticóide em casos em que a
pressão arterial não responde às drogas vasoativas, especialmente se acompanhado de
hipoglicemia (se possível, dosar o cortisol [<(<5g/dL caracteriza a insuficiência adrenal
relativa]). Hidrocortisona: dose de 1 mg/kg/dose, de 8/8 horas ou 20 a 40 mg/m2/dia por 5
dias em infusão venosa. Área corporal (m2) = (0,05 x kg) + 0,05. Em RN, prognóstico
com altas doses de glicocorticóides é substancialmente pior. Se estas drogas têm ou não um
papel no tratamento do choque séptico e outras formas de choque no RN e qual a dose a ser
usada, ainda não está estabelecido. (
5. Uso do diurético:
Furosemida possui uma base fisiopatológica para ser usada na IRA. É uma
sulfonamida, cujo sítio de ação primário é o ramo ascendente da alça de Henle. A droga se
liga fortemente às proteínas (98%), e apenas uma pequena parte é filtrada pelo glomérulo. O
seu efeito farmacológico não é percebido até que ela atinja o túbulo proximal (seja
secretada). No interior do túbulo (lúmen) ela age inibindo a reabsorção ativa de Na+ , K+ e
Cl-. O acúmulo desses íons afeta a carga ao nível de membrana, inibindo a reabsorção
passiva de potássio, cálcio e magnésio. Ela também atua inibindo a reabsorção de NaCl a
nível de túbulo proximal e distal por mecanismos indeterminados envolvendo a anidrase
carbônica. Uma vez reduzindo o transporte ativo, furosemida tem um efeito protetor, pois
reduz o consumo de O2 e a energia gasta pelas células tubulares, que estão vulneráveis ou já
danificadas.
O fluxo sanguíneo renal aumenta após administração de furosemida, provavelmente
secundária a vasodilatação mediada por prostaglandina (por estimular a via reninaangiotensina). Esta propriedade da droga torna o seu uso racional no tratamento da IRA
secundária a hipóxia, hipovolemia, hipotensão e nefropatia vasomotora, onde existe um
período crítico anterior à instalação da NTA, quando prostaglandinas exercem um papel
vital na manutenção do fluxo sanguíneo e na filtração glomerular.
O aumento de sal e água na luz tubular resulta num acréscimo do fluxo urinário
intratubular, o que parece ser intuitivamente necessário para deslocar células e debris do
bordo em escova, acumulados na luz após injúria isquêmica, provocando obstrução.
Portanto, furosemida é um diurético de alça que tem um mecanismo direto que
provoca aumento na excreção de sal e de água e, em decorrência, possui benefícios
indiretos na IRA, contribuindo para a recuperação celular reduzindo o gasto energético,
promovendo a secreção de prostaglandina e provocando um clearance de debris tubulares.
Administrada em uma fase adequada, furosemida pode converter IRA oligúrica em
não-oligúrica, em casos em que a IRA parece inevitável. IRA não oligúrica está associada a
um melhor prognóstico, e tem sido sugerido que pacientes que respondem a furosemida
devem ter uma IRA menos grave. Antes do seu uso, especial atenção deve ser dada à
correção da hipotensão e da acidose importante. Cateterismo vesical está indicado para
aferição rigorosa do débito urinário.
A droga deve ser administrada preferencialmente por via endovenosa, e a resposta
diurética pode ser vista em 2 –5 minutos após a infusão, com pico de 30 minutos (com
função renal preservada). Na IRA, depois de uma dose adequada, a resposta pode ocorrer
em 2 – 4 h. Dose recomendada in bolus: 0,5 a 1 mg/Kg .
Como descrito acima, a droga só age uma vez atingindo a luz do túbulo proximal;
portanto, com baixa perfusão renal haverá uma baixa liberação da droga aos rins. Em RN
com IRA, os ácidos orgânicos acumulados competem com a droga na secreção tubular, e
apenas 10 a 20% dela é secretada no lúmen. Assim sendo, pode-se preconizar o uso de
doses maiores (2 – 5 mg/Kg, in bolus, numa velocidade que não ultrapasse 4 mg/Kg/min).
Na ausência de resposta ao tratamento, não existe justificativa para o uso de doses
adicionais.
Obs: Para RN com IG >= 32 semanas, a droga deve ser administrada a cada 12
horas
Para RN < 32 semanas, a droga deve ser administrada de 24/24 horas, devido a
meia vida longa. Assim, o risco de ototoxicidade pode ser evitado.
Infusão contínua ou de horário?
Estudos em PO de cirurgia cardíaca em RN demonstraram que infusão contínua é
segura e melhora o débito urinário. Em pacientes com IRA não há indicação para infusão
contínua a menos que haja resposta depois de uma dose inicial de furosemida in bolus.
Dose inicial: 0,1 mg/Kg/hora. Considerando-se o conhecimento sobre a liberação e ação da
droga na IRA, a administração in bolus é mais comumente utilizada.
Toxicidade:
Hiponatremia; hipocalemia; instabilidade hemodinâmica (é preciso controlar o BH
rigorosamente); seu uso prolongado está associado com alcalose metabólica hipoclorêmica
e hipercalciúria, podendo levar a nefrocalcinose. Ototoxicidade é bem estabelecida, embora
o mecanismo exato seja ainda desconhecido.Pode ser prevenida evitando-se o acúmulo da
droga, administração rápida in bolus, uso concomitante de outras drogas ototóxicas, como
os aminoglicosídeos (uso simultâneo aumenta a incidência de surdez neurosensorial),
vancomicina.Outras associações perigosas: indometacina e inibidores da enzima conversora
de angiotensina (Captopril).
TRATAMENTO DAS COMPLICAÇÕES
1- Hiponatremia
- Origem iatrogênica (sobrecarga hídrica
- Se Na+ plasmático >120 ou sem sintomas - Restrição Hídrica.
- Se Na < 120 ou se houver manifestação neurológica , administrar NaCl- 3% .
Cálculo:
(0,5 mEq = 1 ml, diluir NaCl 20% 11x em água destilada) Correção Sódio para = 125 mEq
Na = (Na desejado - Na inicial) x 0,7 x Peso (2 horas). Consulte o capítulo de Hidratação
Venosa.
2- Hipercalemia:
a) K+ 5.5 a 7.0 mEq/l com ECG normal
Diminuir aporte VO ou EV, correção da acidose.
b) K+ > 7 mEq/l, com alterações no ECG (ondas T elevadas, Fibrilação)
Gluconato de cálcio 10% - 0,5 a 1 ml/Kg/ (2-4 min) monitorização
Glicose + insulina regular (solução polarizante): 1 U insulina / 4g glicose
Ex: RN c/ 1.2 kg e 7 mEq/l de potássio: 19.2ml SG 25% + 4.8 U de insulina
regular
4g glicose x 1.2 kg = 4.8g de glicose e 1ml SG 25% = 0.25g de glicose. Então, 4.8g de
glicose equivale a (4.8 0.25) = 19.2 ml SG 25% (consulte o capítulo de Hidratação
Venosa).
Se não houver resposta: salbutamol – 5 mcg/kg em 15 min (o K+ sérico cai
significantemente em 15 minutos; o salbutamol, que é um estimulador beta 2, induz a
entrada do K+ para a célula. Alguns centros utilizam o salbutamol como a primeira linha de
tratamento da hipercalemia; 1 ml de salbutamol = 0.5mg = 500mcg). Manutenção:
0,2mcg/Kg/min
Correção da acidose metabólica com bicarbonato de sódio: O metabolismo celular produz
cerca de 2 mEq/kg/dia de ácido fosfórico, sulfúrico e ácidos não voláteis. Estes ácidos são
tamponados pelo bicarbonato extracelular, gerando CO2, água e sais de ânion ácido. A
homeostasia é preservada pelos rins, que excretam ácidos e regeneram o bicarbonato,
consumido na reação de tamponamento. A correção da acidose metabólica na IRA deve ser
cuidadosa, pelo risco de desenvolver hipocalcemia e sobrecarga hídrica. Na verdade, esta
correção deve ser secundária à correção da causa base; quando não for possível, através s de
meios dialíticos.
Diálise peritoneal.
3- Hipertensão arterial
Restrição hídrica ou diálise peritoneal
Elevações agudas = administração de drogas como:
Hidralazida 0.1-0.5 mg/kg/dose, 6/6 horas EV e por VO ÷ 0.25 - 1mg/kg/dose
cada 6-12h
(Apresolina R) 1 amp.= 20 mg/ml.
1 comp = 25 mg e 50 mg
Efeito adverso: taquicardia. Iniciar propanolol na dose de 0.1 mg/kg/dose de 6/6/ ou 8/8 h,
em 10 min. EV. se VO: 0,25 mg/kg/dose de 6/6/ ou 8/8h (Inderal R; 1 ampola = 1 ml = 1
mg e comp. = 10 mg)
Metildopa : 2.5 - 10. mg / Kg/ dose, 12/12h - VO Inconveniente: nem sempre é possível
utilizar a via oral.
Aldomet R; 1 comp= 250mg e 500 mg
Captopril : 0,1-0,4 mg/Kg/dose (1 a 4 vezes/dia). Iniciar com 0,1 e aumentar
semanalmente - Capoten R : 1 comp. = 12, 5, 25 e 50 mg.
4- Anemia
Quando severa: concentrado de hemácias 10 ml/Kg (2 horas)
5- Hipocalcemia
Suplementação de cálcio ou derivados da vitamina D
6- Convulsões:
Correção dos distúrbios metabólicos
Anticonvulsivantes (Consultar capítulo de Convulsões Neonatais)
7- Acidose metabólica
RN <= 1500 g: manter pH > 7.20
RN > 1500 g: manter pH > 7.25
Atenção para risco de tetania, convulsões, pela diminuição do cálcio ionizado,
após correção da acidose.
8- Infecções:
Uso do antibiótico dependendo da sensibilidade da bactéria, tendo a dose ajustada
ao grau de distúrbio renal
9- Diálise
Diálise peritoneal é preferível em relação à hemodiálise (dificuldades técnicas).
Indicações:
Acidose intratável
Hipercalemia intratável;
Hipernatremia
Expansão anormal do fluído extracelular com hipertensão e insuficiência cardíaca
congestiva. Rápida deterioração na condição clínica geral (convulsão, coma)
Solução de Diálise a ser usada deve conter bicarbonato, pois solução com lactato aumenta
o risco de acidose lática). Usar:
volume: de 25-50 ml/kg por ciclo, com tempo de permanência entre 30-60 minutos.
Contra-indicações:
Peritonite , enterocolite necrosante ou cirurgia abdominal
Coagulopatia
Derivação ventrículo-peritoneal
Íleo paralítico
Insuficiência respiratória (vigiar expansibilidade pulmonar).
Na presença de contra-indicação da diálise peritoneal, indica - se a Hemofiltração Artériovenosa contínua (tem o inconveniente da necessidade de heparinização contínua e
reposição de fluidos). A hemodiálise é dificilmente empregada no período neonatal.
MÉTODO:
Realizar a omentectomia e usar o catéter neonatal Tenkoff:
1. Realizar dois ou três banhos de prova, com tempo de permanência zero (banhos
contínuos).
2. Iniciar os banhos com solução a 1,5%
3. Volume de troca: 10-20 ml/kg
4. Tempo do ciclo: primeiras horas ( Infusão: 5 minutos, tempo de permanência: 45
minutos, drenagem: 10 minutos). Tempos de permanência menores melhoram a
troca de solutos de baixo peso molecular.
5. Heparina: usar 250 UI por litro de dialisado
6. Temperatura 38ºC
7. Banhos: Isotônicos: 1,5%, Hipertônicos: 4,25%. Depende da quantidade de
volume a ser retirada (banhos hipertônicos causam maior irritação peritoneal,
porém retiram maior volume).
8. Potássio: acrescentar nos banhos na concentração de 4mEq/l, quando o potássio
sérico cair abaixo de 4mEq/L
9. Infecção: em caso de suspeita, colher líquido peritoneal e enviar para análise e
cultura. Peritonite 100 leucóciots/mm3
10.
Acidose: o dialisado contém lactato como tampão. Bebês e pacientes com
insuficiência hepática não conseguem converter lactato em bicarbonato. Não se
deve acrescentar bicarbonato à bolsa, porque ela contém cloreto de cálcio, que
formará cristais com o bicarbonato. Corrigir cm bicarbonato quando necessário.
11. Bolsa com solução iso ou hipertônica.
1. Med-med
1
3
2
4
5
6
2. Bolsa pequena com solução aquecida para o paciente.
3. Bolsa pequena para drenagem.
4. Med-med
5. Bolsa grande
DIÁLISE PERITONEAL
1 * Transferir da bolsa número 1 (solução isotônica) ou da bolsa número 2 (solução hipertônica) para o
microfix a quantidade de solução conforme prescrição.
2 * Clampear a pinça após transferência.
3 * Transferir a solução do microfix para bolsa intermediária (bolsa n. 03 )fechar clamp.
4 * Após aquecimento da solução, abrir o clamp e infundir a solução na cavidade abdominal do recém
nascido. Fechar o clamp.
5 * Anotar o início e o término da infusão.
6 * Deixar a solução na cavidade o tempo determinado na prescrição (tempo de perfusão).
7 * Abrir o clamp na extremidade de saída do circuito e deixar drenar para bolsa pequena (número 3), que
está na parte inferior do carrinho. Fechar o clamp após a drenagem.
8 * Anotar o início e o término da drenagem.
9 * Transferir a solução drenada (bolsa número 4) para o microfix . 2, fechar o clamp anotar o volume e
transferi-lo para a bolsa número 4 ( final ) . No ítem observações registrar o aspecto da solução drenado
e/ou intercorrências.
Obs : Ao terminar a infusão da solução para o recém nascido e fechar o clamp , voltar a preencher a bolsa
intermediária ( número 2) com a solução prescrita e deixá-la na placa em aquecimento.
10 * Anotar no ítem balanço, a diferença entre o volume infundido(solução ) e o volume
drenado(total).Registrar o balanço como negativo quando a drenagem for maior que a infusão e positivo
quando a infusão for maior que a drenagem.
PROGNÓSTICO:
- Mortalidade: 33 - 78%; depende da natureza e severidade da lesão renal inicial e
habilidade com que os distúrbios bioquímicos são manuseados.
- Critérios de mau prognóstico:
Anúria de 4 dias ou mais
Falta de visualização renal pela cintilografia.
Falência múltipla de órgãos.
Bibliografia
1.Marques A. Insuficiência Renal Aguda. In: Marba STM, Filho Mezzacappa F. Manual de
Neonatologia. UNICAMP- Revinter, Rio de Janeiro, pg 147, 1998.
2.Kemper MJ, Harps E, Muller - Wiefel DE. Hyperkalemia: therapeutic options in acute
and chronic renal failure. Clin Nephrol 46: 67, 1996
3.Lorenz JM, Kleinman LI, Markarian K. Potassium metabolism in extremely low birth
weight infants in the first week of life. J Pediatr 131: 81, 1997
4.Margotto PR. Insuficiência renal aguda. Boletim Informativo Pediátrico- BIP (Brasília),
N º 42, 1985.
5.Atiyeh BA, Dabbagh SS, Gruskin AB. Evaluation of renal function during childhood.
Pediatr Rev 17:175, 1996.
6.Stewart CL, Barnett R. Acute renal failure in infants, children, and adults. Crit Care Clin
13:575, 1997.
7.Sherbotie JR. Insuficiência renal no recém-nascido. In: Polin RA, Yoder MC, Burg FD.
Neonatologia Prática, 2ª Edição, Artes Médicas, Porto Alegre, pg 315, 1996.
8.Huet F, Semama D, Grimaldi M, Guignard JP, Gouyon JB. Effects of theophylline on
renal insufficiency in neonates with respiratory distress syndrome. Intensive Care Med
21:511, 1995.
9.Rahman N et al. Renal failure in the perinatal period. Clin Perinatol 8: 241, 1981.
10.Procianoy SR. Choque no recém-nascido. In. Margotto PR. Boletim Informativo
Pediátrico (BIP), Brasília, N° 64, pg 179, 2001 (disponível em www.paulomargotto.com.br
em Choque no Recém-Nascido)
11- Gaissmaier RE, Pohlandt F. Single-dose Dexamethasone Treatment of Hypotension in
Premature Infants. J Pediatr 134:70, 1999
12- Bourchier D. Randomised trial of dopamine compared with hydrocortisone for
treatment of hypotensive very low birthweight infants. – Arch Dis Child Fetal Neonatal Ed
76: F174, 1997
12.Karlowicz MG, Aldeman RD. Nonoliguric and oliguric acute renal failure in
asphyxiated term neonates. Pediatr Nefhrol 9: 718, 1995
13.Miranda LEV. Distúrbios do metabolismo do sódio no período neonatal. In. Margotto
PR. Boletim Informativo Pediátrico (BIP), Brasília, N° 64, pg 153, 2001
14.Suporte avançado de vida em pediatria. American Academy of Pediatrics. American
Heart Association, American Heart association Capítulo 6, pag 13, 1977.
15.Chameides L, Hazinski M.Fluidoterapia e Medicação. American Academy of
Pediatrics/Amwerican Heart Association, pg 6-1, 1997
16-Kluckow M. Avaliação do fluxo sanguíneo sistêmico no recém-nascido pré-termo,
Complicações do baixo fluxo sistêmico e Tratamento da hipotensão arterial ou fluxo
sanguíneo baixo no recém-nascido prematuro. In. Margotto PR. Suporte cardiovascular no
recém-nascido pré-termo extremo. Boletim Informativo Pediátrico (BIP), N° 66, pg 140,
2003. Disponível em www.paulomargotto.com.br em Farmacologia Neonatal
16.N E Moghal NE, Shenoy M. . Furosemide and acute kidney injury in neonates. Arch Dis
Child Fetal Neonatal Ed 93:F313, 2008
17. Barrington KJ. Hypotension and shock in the preterm infant. Semin Fetal Neonatal
Med. 13:16, 2008
18.Barrington KJ. Hipotensão permissiva no recém-nascido. VI Simpósio Internacional de
Neonatologia do Rio de Janeiro (28 a 30 de agosto de 2008). Realizado Márcia Pimentel e
Paulo R. Margotto. Disponível em www.paulomargotto.com.br, em Choque no RecémNascido.
19.Pimentel M, Margotto PR. Insuficiência adrenal relativa no choque séptico: um
problema identificável que requer tratamento (01/08/2007). Disponível em
www.paulomargotto.com.br em Choque no Recém-Nascido.
20.A.Auron and MJ Mhanna. Serum creatinine in very low birth weight infants during their
first days of life. J Perinatol 26:755, 2006.
21-Belik J.Avaliação do débito cardíaco e novas terapias de suporte hemodinâmico.
XIX Congresso Brasileiro de Perinatologia, 25 a 28 de novembro de 2007. Realizado por
Paulo R. Margotto. Disponível em www.paulomargotto.com.br em Choque no RecémNascido.