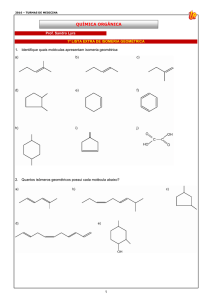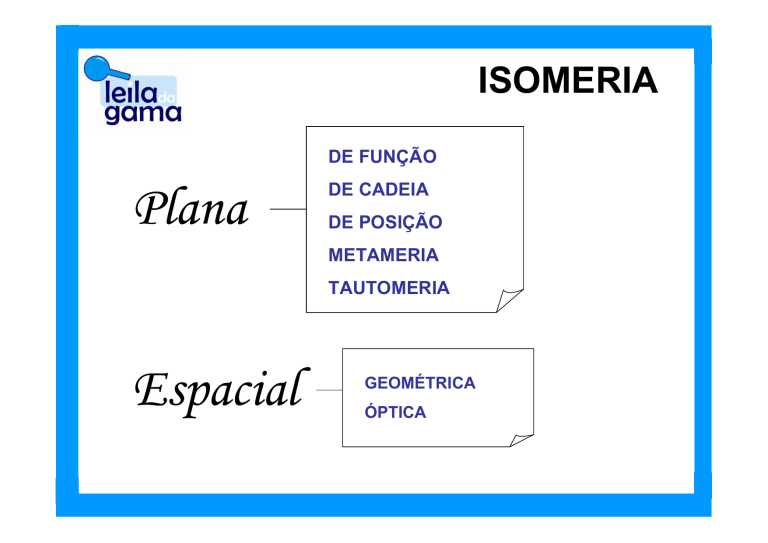
ISOMERIA
DE FUNÇÃO
Plana
DE CADEIA
DE POSIÇÃO
METAMERIA
TAUTOMERIA
Espacial
GEOMÉTRICA
ÓPTICA
ISOMERIA PLANA
não
DE FUNÇÃO
TEM ENOL?
não
sim
TAUTOMERIA
= FUNÇÃO?
não
sim
= CADEIA?
DE CADEIA
sim
TEM HETEROÁTOMO?
não
DE POSIÇÃO
sim
METAMERIA
ISOMERIA DE FUNÇÃO
= FÓRMULA MOLECULAR, ≠ FUNÇÃO
ÁLCOOL e ÉTER
= CnH2n + 2O
ALDEÍDO e CETONA
= CnH2nO
ÁCIDO
CARBOXÍLICO e
ÉSTER = CnH2nO2
ISOMERIA DE CADEIA
= FÓRMULA MOLECULAR, = FUNÇÃO e ≠ CADEIA
NORMAL x RAMIFICADA
ABERTA x FECHADA
HOMOGÊNEA x HETEROGÊNEA
CH3 - CH2 - NH2
CH3 - NH -CH3
ISOMERIA DE POSIÇÃO
= FÓRMULA MOLECULAR, = FUNÇÃO , = CADEIA e ≠ nº
LIGA DUPLA ou TRIPLA
GRUPO FUNCIONAL
ISOMERIA DE POSIÇÃO
RAMIFICAÇÕES
METAMERIA
São isômeros de mesma função química, com
cadeias heterogêneas, que diferem pela localização
do heteroátomo nas cadeias.
ÉTER
ÉSTER
AMINA SECUNDÁRIA
AMIDA SECUNDÁRIA
METAMERIA
TAUTOMERIA
Caso particular da isomeria de função, no qual os isômeros coexistem
em equilíbrio dinâmico em solução.
Os principais casos da tautomeria (tautos = dois de si mesmo)
envolvem compostos carbonílicos. Ao preparar puma solução de
aldeído acético, uma pequena parte se transforma em etenol, o qual,
por sua vez, regenera o aldeído, estabelecendo um equilíbrio químico
em que o aldeído, por mais estável, está presente em maior
concentração.
TAUTOMERIA
EQUILÍBRIO CETO-ENÓLICO
EQUILÍBRIO ALDO-ENÓLICO
Isomeria
Espacial
Estereoisomeria
GEOMÉTRICA
“C amarrados”
Cadeia aberta
a
C
c
a
c
d
b
d
C
b
a≠b
Cadeia fechada
e
c≠d
Liga dupla e dois ligantes diferentes
em cada carbono da liga dupla.
a≠b
e
c≠d
Ciclo saturado e dois ligantes
diferentes em dois C
quaisquer do ciclo.
GEOMÉTRICA
GEOMÉTRICA
cis
os dois ligantes mais simples
estão do mesmo lado da molécula.
trans
os dois ligantes mais simples
estão em diagonal.
Fórmula molecular: C2H2Cl2
Fórmula molecular: C2H2Cl2
Massa molar: 97 g/mol
Massa molar: 97 g/mol
PE: 600C
PE: 490C
Densidade = 1,28 g/cm3
Densidade = 1,26 g/cm3
O isômero cis é mais polar que o trans.
O isômero trans tem maior simetria molecular.
GEOMÉTRICA
Feromônio sexual da mosca doméstica:
H3C —(CH2)7 —CH = CH—(CH2)12— CH3
natural
GEOMÉTRICA
Retinal
responsável
pela visão no
escuro.
Derivado da
vitamina A.
ÁCIDOS GRAXOS
GEOMÉTRICA
O isômero chamado E é o trans.
O isômero chamado Z é o cis.
O ligante que tiver maior número atômico terá maior prioridade.
ÓPTICA
C quiral ou assimétrico
Cadeia aberta
Cadeia fechada
a
b
a
*
C
d
c
*
a≠b
a≠b≠c≠d
2 ligantes diferentes
4 ligantes diferentes
b
ÓPTICA
Os isômeros ópticos são:
DESTRÓGIRO = desvia o plano de luz polarizada para a direita.
LEVÓGIRO = desvia o plano de luz polarizada para a esquerda.
CHO
CHO
H
C
OH
CH2OH
D-gliceraldehido
HO
C
H
CH2OH
L-gliceraldehido
Enantiômeros ou antípodas ópticos
ÓPTICA
MISTURA RACÊMICA = não desvia. É formado por uma mistura equimolar
de um destrógiro e um levógiro .
50% d + 50% l
POLARÍMETRO
ÓPTICA
Aspartame doce
Aspartame amargo
ÓPTICA
TALIDOMIDA
ÓPTICA
levógira teratogênica
ÓPTICA
ÁCIDO LÁCTICO
Louis Pasteur
1822 – 1895
ÓPTICA
CÁLCULO DO Nº DE ISÔMEROS ÓPTICOS
2n
n = nº de C*
GLICOSE = 2,3,4,5,6 penta-hidróxi-hexanal
∗
∗
∗
∗
CH2 - CH - CH - CH - CH - CHO
⏐
⏐
⏐
⏐
⏐
OH OH OH OH OH
ISÔMEROS ATIVOS = 24 = 16 ( 8 d e 8 l )
MISTURAS RACÊMICAS = 8 dl
DIASTEREOISÔMEROS = são isômeros ópticos da mesma
substância, mas não são antípodas, ou seja, desviam o plano
de vibração da luz polarizada em ângulos diferentes.
tetroses = dois carbonos assimétricos distintos
H
OH
HO
H
HO
H
OH
HO
H
H
CH 2OH
CH 2OH
- a°
eritroses
+ a°
CHO
CHO
CHO
CHO
H
OH
H
HO
H
CH2OH
CH 2OH
- b°
OH
treoses
+ b°
– a° e + a°, – b° e + b° são enantiômeros ou antípodas ópticos
– a° e – b°, – a° e + b°, +a° e – b°, +a° e +b° são diastereoisômeros,
MESO = Ocorre quando a molécula tem simetria interna
(dois carbonos assimétricos iguais). É inativo.
O exemplo clássico é o ácido tartárico:
HOOC – CHOH – CHOH – COOH.
H
OH
HO
H
HO
H
OH
HO
H
H
COOH
COOH
meso
COOH
COOH
COOH
COOH
H
OH
H
OH
HO
H
COOH
COOH
(-)
(+)
ISOMERIA ÓPTICA EM COMPOSTOS CÍCLICOS
H
H
H
HO
OH
HO
OH
H
trans - d
cis
MESO
HO
H
OH
H
trans - l