1/3
Programa de Pós-Graduação em Química
PROVA DE CONHECIMENTOS ESPECÍFICOS
Duração da Prova: 4 horas
Nome Completo (legível):_____________________________________________________
_________________________________
Assinatura
São José do Rio Preto, 23 de Junho de 2009.
1Departamento de Química e Ciências Ambientais - DQCA
2/3
Questão 01. Segundo a definição de Bronsted-Lowry, ácido são substâncias que doam prótons e base
recebem prótons. O etanol (CH3CH2OH) tem pKa = 16, o fenol pKa = 9,9, a amônia pKa = 38 e a
propanona pKa = 19,2 e o ácido etanóico pKa = 4,76. Com base nessas informações e definição,
responda:
a) Qual desses compostos é o mais ácido e qual é o mais básico? Justifique.
b) Explique a diferença de acidez entre o etanol e o ácido etanóico.
Questão 02. Ácido benzóico (C6H5CO2H, 2,00g) e benzoato de sódio (NaC6H5CO2, 2,00 g) são
dissolvidos em água suficiente para se obter 1,00 L de solução. A constante de ionização para o ácido
benzóico é 6,3 x 10-5. Com base nessas informações responda as questões abaixo.
a) Calcule o pH desta solução.
b) Se você pegar 100 mL desta solução em um béquer e adicionar duas gotas de ácido clorídrico (HCl)
0,01 mol L-1, o que vai ocorrer com o pH da solução? Explique.
Dados: Massa atômica: C = 12; H = 1; O = 16; Na = 23
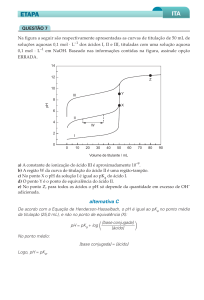
Questão 03. Fornecido os dados abaixo referentes à titulação de dois ácidos: A) Em sua opinião, como
deveria ser o perfil da curva de titulação (pH x Volume do titulante), para a titulação de cada ácido a
partir de uma base forte de mesma concentração? (Desenhar um esboço da curva e justificar o porquê do perfil);
B) como seria o perfil esperado para a titulação de uma mistura equimolar dos dois ácidos com solução
da mesma base forte? Apresentar o esboço (Desenhar um esboço da curva e justificar o porquê do perfil).
Dados:
HX H+ + HX-; kia1 = ∞
HP H+ + P- ; kia2 = 1,25x10-5
kia1 = Constante de ionização do ácido (HX)
kia2 = Constante de ionização do ácido (HP)
Questão 04. Fornecidos os dados de uma solução de amônia em água (Título= 30 % (m/m) d= 0,950 g
mL-1) e que um volume de 59,65 mL desta solução foi transferida para um balão de 1L, para preparar
uma solução diluída desta base fraca, solicita-se: qual a concentração desta nova solução (explicitar os
cálculos)?
Questão 05. De forma contrária à maior parte das substâncias, a densidade da água diminui com a
diminuição da temperatura entre 4oC e 0oC. Isto ocorre devido a qual evento dentre os mencionados a
seguir: interação dipolo-dipolo, forças de dispersão de London, diminuição do número de ligações tipo
ponte de hidrogênio ou aumento do número de ligações tipo ponte de hidrogênio? Comente a sua
resposta.
Questão 06. Responda as questões abaixo.
a) O brometo de césio (CsBr) exibe ligação predominante iônica. Os íons Cs1+ e Br1- possuem
estruturas eletrônicas que são idênticas àquelas de quais gases nobres?
b) Desenvolva as configurações eletrônicas para os seguintes íons: Fe2+, Cu+.
2Departamento de Química e Ciências Ambientais - DQCA
3/3
Questão 07. Relacione as estruturas dos lipídeos (ácido graxos) dados abaixo, com seus respectivos
pontos de fusão:
A) Ácido oléico (18:1)∆9, B) Ácido araquídico (20:0), C) Ácido linoléico (18:2)∆9,12, D) Ácido
esteárico (18:0), E) Ácido araquidônico (20:4) ∆5,8,11,14
(
(
(
(
(
) 76,5 oC
) 69,6 oC
) 13,4 oC
) –5 oC
) –49,5 oC
Ácido araquídico
Ácido linoléico
Ácido oléico
Ácido esteárico
Ácido araquidônico
Questão 08. Defina equilíbrio químico, dê um exemplo e explique os efeitos de variações de:
a) pressão b) temperatura c) e presença de um catalisador.
Questão 09. Desenhe as estruturas de Lewis e indique a geometria para as moléculas abaixo:
a) HNO2 ; SF6 ; SO3-2 ; OCN-1
b) Desenhe as estruturas de ressonância para a molécula OCN-1 indicando qual delas é mais estável.
Dados: Números atômicos: C = 6; H = 1; O = 8; S = 16; N = 7, F= 17
Questão 10. Dada a pilha representada abaixo:
Cd+2Cd (s) Ni(s)Ni+2
a) Indique quem sofre oxidação e quem sofre redução e escreva a reação espontânea.
b) Forneça a relação de concentrações para que a pilha apresente uma voltagem de 0,20 Volts.
c) Calcule a constante de equilíbrio para a reação espontânea.
Dados:
Cd+2 + 2é = Cd(s) E0 = -0,40 V
Ni+2 + 2é = Ni(s) E0 = -0,25 V
_______________________________________
Boa Prova!
3Departamento de Química e Ciências Ambientais - DQCA