2. EXAME PRÁTICO QUIMICA ANALÍTICA
Primeira parte
No mês de setembro passado caíram fortes chuvas na Cidade do México causando severas inundações. Como
conseqüência de uma destas chuvas, a água entrou em um depósito da Faculdade de Química da UNAM e alguns
frascos de reagentes colocados nas prateleiras inferiores se molharam e suas etiquetas se desprenderam, porém,
todas foram conservadas separadas de seus frascos pelo sabemos que eram ácidos ou sais de cor branca e com
qualidade de reagente analítico.
Sua tarefa esta tarde será ajudar-nos a identificá-los. Para adiantar o trabalho pesamos com exatidão quantidades
conhecidas de cada um destes compostos, dissolvemos em água destilada e conhecemos sua concentração exata,
expressa em gramas/litro.
Antes de iniciar o trabalho experimental revise com cuidado a tabela dos possíveis compostos que são indicados
abaixo. Considere que para identifica-los você pode usar somente dois tubos de ensaio, material volumétrico
simples, uma solução de NaOH de concentração previamente determinada e soluções de 2 indicadores:
fenolftaleína (intervalo de viragem = 8,0 a 9,2) e vermelho de metila (intervalo de viragem = 4,2 a 5,4).
Planeje uma forma de identificá-los e responda a primeira folha de perguntas. Quando terminar, entregue esta
folha de planejamento a um supervisor que lhe dará una segunda folha informativa para você realizar seu
trabalho prático. (recomendamos não usar mais de 15 minutos para esta parte)
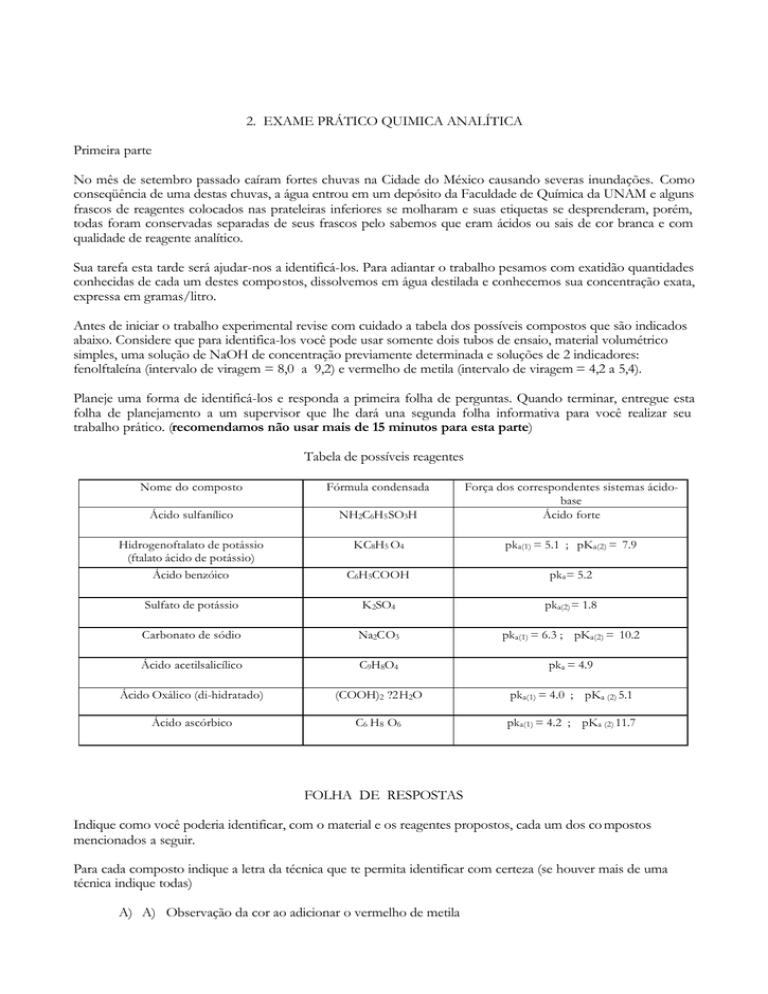
Tabela de possíveis reagentes
Nome do composto
Fórmula condensada
Ácido sulfanílico
NH2C6H5 SO3H
Força dos correspondentes sistemas ácidobase
Ácido forte
Hidrogenoftalato de potássio
(ftalato ácido de potássio)
Ácido benzóico
KC8H5 O4
pka(1) = 5.1 ; pKa(2) = 7.9
C6H5COOH
pka= 5.2
Sulfato de potássio
K2SO4
pka(2) = 1.8
Carbonato de sódio
Na2CO3
pka(1) = 6.3 ; pKa(2) = 10.2
Ácido acetilsalicílico
C9H8O4
pka = 4.9
Ácido Oxálico (di-hidratado)
(COOH)2 ?2H2O
pka(1) = 4.0 ; pKa (2) 5.1
Ácido ascórbico
C6 H8 O6
pka(1) = 4.2 ; pKa (2) 11.7
FOLHA DE RESPOSTAS
Indique como você poderia identificar, com o material e os reagentes propostos, cada um dos co mpostos
mencionados a seguir.
Para cada composto indique a letra da técnica que te permita identificar com certeza (se houver mais de uma
técnica indique todas)
A) A) Observação da cor ao adicionar o vermelho de metila
B)
C)
D)
E)
B)
C)
D)
E)
Titulação ácido base utilizando vermelho de metila
Titulação ácido base utilizando fenolftaleína
Observação da cor ao adicionar fenolftaleína
Titulação do precipitado
Composto
Técnica(s) de identificação
Ácido sulfanílico
Hidrogenoftalato de potássio
(ftalato ácido de potássio)
Ácido benzóico
Sulfato de potássio
Carbonato de sódio
Ácido acetilsalicílico
Ácido Oxálico (di-hidratado)
Ácido ascórbico
Assinatura do supervisor__________________________________
2. EXAME PRÁTICO QUIMICA ANALÍTICA
Segunda parte
Informação adicional
O chefe do depósito acaba de informar que na prateleira afetada pela inundação, somente se encontravam ácidos
orgânicos. Por tanto, seu problema pode conter, unicamente, algum dos seguintes compostos. Identifique-o
titulando com NaOH e fenolftaleína como indicador.
Nome do composto
Fórmula condensada
Ácido sulfanílico
Hidrogenoftalato de potássio
(ftalato ácido de potássio)
Ácido benzóico
Ácido acetilsalicílico
Ácido Oxálico
(di-hidratado)
NH2C 6H5SO3H
MATERIAL INDIVIDUAL DISPONÍVEL
1 Bureta de 25,00 mL
1 suporte com garra para bureta
KC8H5 O4
C 6H5COOH
C9 H8O4
(COOH)2 ´2H2O
Força dos correspondentes sistemas
ácido-base
Ácido forte
pka(1) = 5.1 ; pKa(2) = 7.9
pka= 5.2
pka = 4.9
pka(1) = 4.0 ; pKa (2) 5.1
3 Erlenmeyer
1 béquer de 150 mL.
1 pipeta volumétrica de 10,00 mL
1 seringa com pêra, para encher a pipeta (em substituição à propipeta)
1 frasco conta-gotas com fenolftaleína
1 frasco com solução padronizada de NaOH (a concentração exata está indica na etiqueta)
1 frasco com a solução problema
Este material lhe permitirá realizar a titulação de sua solução problema e identificá-la.
2. EXAME PRÁTICO QUIMICA ANALÍTICA
FOLHA DE RESPOSTAS
Número da solução problema________________________
Concentração da solução problema (em g/litro) ________________
Concentração da solução de NaOH __________________
Volume de NaOH gasto nas titulações
Volume 1 _________________
Volume 2_________________
Volume 3 _________________
Volume utilizado nos cálculos ________________________
Cálculos para identificar o ácido
O ácido orgânico contido em sua amostra é _________________________
10 pontos












