ICS – Instituto de Ciências e Saúde
Curso – Química Geral
2 lista de exercícios
1)
Observem as substâncias da tabela abaixo:
Leite
Água do mar
Coca-cola
Café preparado
Lágrima
Água de lavadeira
[H+]
1,0 . 10-7
1,0 . 10-8
1,0 . 10-3
1,0 . 10-5
1,0 . 10-7
1,0 . 10-12
[OH-]
?
?
?
?
?
?
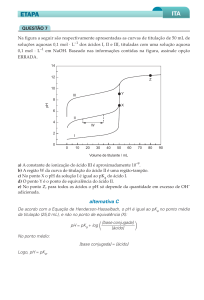
Aplicando a equação do pH, tem caráter ácido apenas:
a) o leite e a lágrima
b) a água de lavadeira
c) o café preparado e a coca-cola
d) a água do mar e a água de lavadeira
e) a coca-cola.
2)
3)
4)
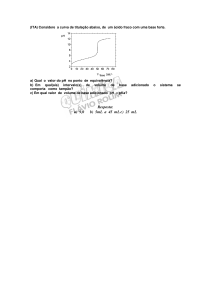
Qual o pH de uma solução cuja concentração
hidrogeniônica (pH) é 3,76.10-8 mols/L. A solução é acida,
básica ou neutra.
Qual é o pH de uma solução cuja concentração
hidoxiliônica (pOH) é 4,8.10–11mols/L. A solução é básica,
neutra ou acida.
Obs : pH+pOH=14
Sabemos que o pKa é conhecido como constante de
dissociação, o qual análogo ao pH e é definido pela
equação
1
pKa log
1
pKa log Ka
Ka
pergunta-se:
Qual das 4 substâncias terá o menor pKa e o maior caráter
acido ?
HCOOH(ácido fórmico)
CH3COOH(ácido acético)
H3PO4 (ácido fórmico)
HCO3- (bicarbonato)
5)
Ka=1,78.10-4
Ka=1,74.10-5
Ka=7,25.10-3
Ka=6,31.10-11
Utilizando a equação de Henderson-Hasselback, calcule a pKa do ácido
láctico sabendo-se que quando a concentração do acido láctico livre de uma
solução é 0,010M e a concentração do seu sal lactato é 0,087M, o pH desta
solução é 4,80
[ sal ]
[ácido ]
Quando 0,05 mols de acido HA foi dissolvido em
quantidade de H2O suficiente para obter 1L da solução
constatou-se que o pH resultou em 2,0, calcular
a) Concentração da solução
b) pKa
pH pKa log
6)
7)
Em solução aquosa de acido acético a 20 0C o acido se
encontrou 1,0% ionizado, o pKa desse acido nessa
temperatura é 1,08.10-3, calcular:
a) molaridade da solução
b) pH da solução
8)
A aspirina é um ácido fraco. Ela é absorvida pela corrente
sanguínea através das células do estômago e do intestino.
Se um paciente ingerir 0,005mols desse acido dissolvido
em quantidade de água suficiente para obter 200mL da
solução, qual o pH?
2