Visualização do documento
ENZIMAS.doc
(78 KB) Baixar
INTRODUÇÃO
1.1.
ENZIMAS
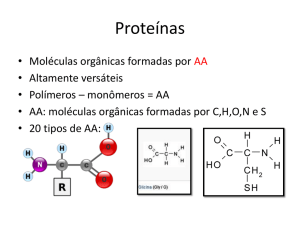
As enzimas são proteínas especializadas na catálise de reações biológicas sob
condições favoráveis de pH, temperatura, concentração do substrato, etc.. Elas estão
entre as biomoléculas mais notáveis devido a sua extraordinária especificidade e poder
catalítico, que são muito superiores aos dos catalisadores produzidos pelo homem.
Praticamente todas as reações que caracterizam o metabolismo celular são catalisadas
por enzimas.
Como catalisadores celulares extremamente poderosos, as enzimas aceleram a
velocidade de uma reação, sem no entanto participar dela como reagente ou produto.
As enzimas podem ser classificadas de acordo com vários critérios. O mais
importante foi estabelecido pela União Internacional de Bioquímica (IUB), e estabelece
6 classes:
Oxidorredutases: São enzimas que catalisam reações de transferência de
elétrons, ou seja: reações de oxi-redução. São as Desidrogenases e as Oxidases.
Se uma molécula se reduz, tem que haver outra que se oxide.
Transferases: Enzimas que catalisam reações de transferência de grupamentos
funcionais como grupos amina, fosfato, acil, carboxil, etc. Como exemplo temos
as Quinases e as Transaminases.
Hidrolases : Catalisam reações de hidrólise de ligação covalente. Ex: As
peptidades.
Liases: Catalisam a quebra de ligações covalentes e a remoção de moléculas de
água, amônia e gás carbônico. As Dehidratases e as Descarboxilases são bons
exemplos.
Isomerases: Catalisam reações de interconversão entre isômeros ópticos ou
geométricos. As Epimerases são exemplos.
Ligases: Catalisam reações de formação e novas moléculas a partir da ligação
entre duas já existentes, sempre às custas de energia (ATP). São as Sintetases.
As enzimas são muito específicas para os seus substratos. Esta especificidade
pode ser relativa a apenas um substrato ou a vários substratos ao mesmo tempo.
Esta especificidade se deve à existência, na superfície da enzima de um local
denominado sítio de ligação do substrato. O sítio de ligação do substrato de uma enzima
é dado por um arranjo tridimensional especial dos aminoácidos de uma determinada
região da molécula, geralmente complementar à molécula do substrato, e ideal espacial
e eletricamente para a ligação do mesmo. O sítio de ligação do substrato é capaz de
reconhecer inclusive isômeros óticos "D" e "L" de um mesmo composto. Este sítio pode
conter um segundo sítio, chamado sítio catalítico ou sítio ativo, ou estar próximo dele; é
neste sítio ativo que ocorre a reação enzimática.
É a parte da enzimologia que estuda a velocidade das reações enzimáticas, e os
atores que influenciam nesta velocidade. A cinética de uma enzima é estudada
avaliando-se a quantidade de produto formado ou a quantidade de substrato consumido
por unidade de tempo de reação.
Uma reação enzimática pode ser expressa pela seguinte equação:
E + S <==> [ES] ==> E + P
O complexo enzima/substrato (ES) tem uma energia de ativação ligeiramente
menor que a do substrato isolado, e a sua formação leva ao aparecimento do estado de
transição "Ts".
A formação de "P" a partir de ES é a etapa limitante da velocidade da reação.
A velocidade de uma reação enzimática depende das concentrações de enzima e
de substrato.
1.2.
ENZIMA INVERTASE
Alguns microrganismos são capazes de produzir diversas enzimas de interesse
industrial. Dentre esses microrganismos a levedura Saccharomyces cerevisiae,
popularmente conhecida como fermento de panificação, produz a enzima invertase que
é capaz de hidrolisar a sacarose para produzir o açúcar invertido (mistura equimolar de
glicose e frutose) que é muito utilizado pela indústria de alimentos, pois a frutose é mais
doce que a sacarose (cerca de 40%) e não cristaliza tão facilmente melhorando a textura
de doces e sorvetes.
Sacarose + H2O → Glucose + Frutose
As enzimas podem atuar na forma livre ou imobilizadas. As moléculas de enzima
podem ser aprisionadas (imobilizadas) numa fase sólida, como em géis de alginato de
cálcio, e permanecerem ativas com a vantagem de serem reutilizadas.
A caracterização cinética de um enzima em laboratório pode ser feita de várias
maneiras. Podemos, no entanto, começar por referir alguns aspectos importantes para
a maioria das estratégias. Em primeiro lugar, é que a mistura de reação contenha todos
os ingredientes necessários, ou seja, um tampão que mantenha o pH pretendido, o
substrato e os cofatores necessários para a catálise. É também o controle da
temperatura, recorrendo-se em geral a um banho termostatizado.
Cofatores são pequenas moléculas orgânicas ou inorgânicas que podem ser
necessárias para a função de uma enzima. Estes cofatores não estão ligados
permanentemente à molécula da enzima, mas, na ausência deles, a enzima é inativa.
A fração protéica de uma enzima, na ausência do seu cofator, é chamada
de apoenzima.
Enzima + Cofator = holoenzima.
1.3.
AÇÚCAR INVERTIDO
A utilização de açúcar líquido na indústria alimentícia constitui em vantagem nas
aplicações onde o açúcar é adicionado em solução. O xarope de açúcar invertido reúne
a elevada solubilidade da frutose à difícil cristalização da glicose, aumentando seu poder
edulcorante e diminuindo os riscos de cristalização. Essas propriedades contribuem para
aumentar o valor desses xaropes para uso em vários produtos alimentícios, sobretudo
na indústria de refrigerantes. O produto de maior interesse comercial é aquele com nível
de inversão próximo a 55%, pois nessa faixa a solubilidade é máxima possibilitando
trabalhar com concentrações em torno de 76,5% de sólidos solúveis, diminuindo assim
a susceptibilidade à contaminação microbiana, sem riscos de cristalização.
Os ácidos usados para produzir açúcar invertido são suco de limão e de outras
frutas, vinagre e cremor tártaro, cuja ação é acelerada pela fervura. A inversão continua
mesmo depois que a mistura esfria. A invertase também pode ser usada para produzir
açúcar invertido a partir da sacarose, porém não quando a solução será cozida, pois o
calor inativa a enzima.
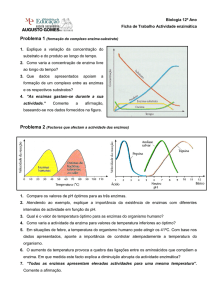
2. PROCEDIMENTO EXPERIMENTAL
Incubou-se os tubos em banho-maria à 37º C por 5 minutos. Adicionou-se 0,2mL
de sacarose 0,01 M em todos os tubos marcando rigorosamente o tempo a partir da
adição da sacarose. Esperou-se o tempo de reação de 5 minutos. Aqueceu-se os tubos
a 100º C por 10 minutos. Acrescentou-se 1mL de reativo de Nelson. Completou-se todos
os tubos até 12,5mL com água destilada. Fez-se a leitura da absorbância a 520nm.
Utilizou-se a curva padrão de açúcar redutor para calcular o aparecimento do produto.
Construiu-se a curva de concentração de enzima, tendo na abscissa as diferentes
concentrações de enzima e na ordenada a atividade enzimática em U/mL que equivalem
a μmol/mL/minuto.
CÁLCULO DA ATIVIDADE ENZIMÁTICA
U/mL = μg de açúcar redutor : 180 : 5
180 = massa molecular do açúcar redutor (para transformar a massa em mol)
5 = tempo de reação enzimática (para ficar por minuto)
3. RESULTADO E DISCUSSÃO
TUBOS
ENZIMA
DILUÍDA 1:25
(mL)
1
2
3
4
5
6
7
8
0
0,05
0,1
0,2
0,3
0,4
0,5
0,6
Tampão
acetato
0,05M pH 4,7
(mL)
0,5
0,5
0,5
0,5
0,5
0,5
0,5
0,5
Água
destilada
(mL)
Absorbância
0,5
0,45
0,4
0,3
0,2
0,1
0
0
0,026
0,045
0,088
0,152
0,259
0,198
0,356
0,364
O branco foi utilizado com um único objetivo de servir como referência para o
espectofotômetro, tento em visto que o valor dessa leitura será descontado das demais
leituras porque a DNS juntamente com a solução tampão, absorve parte da luz incidida,
interferindo assim nos demais resultados.
4. CONCLUSÃO:
Pode-se concluir que ao aumentar a quantidade de enzimas no tubos e,
juntamente com o a redução do volume de água, logo concentrando as soluções, a
atividade enzimática da invertase de levedura aumentou. Fato comprovado pelos
resultados crescentes na absorbância.
REFERÊNCIAS BIBLIOGRÁFICAS
[www.ufscar.br/cobeqic07/pdf/oral/m1.pdf]
[biblioteca.universia.net/ficha.do?id=511304]
Arquivo da conta:
emilioemerson
Outros arquivos desta pasta:
aula_enzimas.ppt (5382 KB)
Bioquimica_-_Enzimas_3º_AULA.ppt (3090 KB)
9_-_Enzimas.pdf (170 KB)
bioquimica-_Enzimas.pdf (314 KB)
ENZIMAS.ppt (150 KB)
Outros arquivos desta conta:
aminoacidos
carboidratos
lipideos
NAF
Nova pasta
Relatar se os regulamentos foram violados
Página inicial
Contacta-nos
Ajuda
Opções
Termos e condições
Política de privacidade
Reportar abuso
Copyright © 2012 Minhateca.com.br