ENZIMAS
(PARTE 1)
Prof. Didier Salmon
MSc Cristiane S.
Lessa
Bioquímica para Enfermagem
Dezembro 2015
02/12/15
X
Conversão
realizada por um
complexo
enzimático!!!
Seres Vivos:
Capazes de manter uma ordem estrutural a
partir de diversas reações químicas essenciais
à sobrevivência e proliferação celular.
Catálise
Replicação
Mas como isso ocorre?
É simples....
.......vias metabólicas!!!!!!!
Vamos por partes...
Enzimas
São proteínas que possuem a função de catálise,
desencadeando reações químicas fundamentais à
manutenção de sistemas biológicos;
São específicos
substratos;
para
os
diversos
tipos
de
A velocidade em que as reações ocorrem variam de
acordo com a temperatura e pH fisiológicos.
Sem a ação catalítica das enzimas no
metabolismo celular, não existiria vida na
Terra!!!
Qual a real importância das
enzimas?
Síntese de macromoléculas
biológicas
Síntese de hormônios
Crescimento corporal
Realizam catálise de reações
(ex. degradação de proteínas)
Medicina:
Excesso, deficiência ou
ausência de certas
enzimas causam doenças
(ex. AST- aspartato
aminotransferase e
infarto do miocárdio )
Diagnóstico de doenças –
pela medida da atividade
específica da enzima ex.
LDH, CK, AST..
Indústria Alimentícia: fermentação,
pasteurização,..
Alterações
Perda de função enzimática:
Ex: Intolerância à lactose (hipolactasia)
Diminuição
da lactase
Ganho de função enzimática:
Ex: Alta atividade de
desiodinases em
pacientes com
hipertireoidismo.
+
Reação espontânea
...................
MUITO TEMPO
DEPOIS...
+
Reação catalisada por
enzimas
Redução do
tempo que ocorre
uma reação que
seria espontânea
= da velocidade
das reações
A enzima amilase degrada amido e
converte em glicose!
Como as enzimas funcionam?
Reação espontânea
Demanda de mais
tempo e gasto
energético para gerar
o produto
Reação catalisada por
enzimas (indicado em
azul claro no gráfico)
Ocorre de forma mais
favorável e rápida
+O
2
CO + H2O
2
Substrato
Enzima-Substrato
Enzima-Produto
Enzima
Produto
Enzima
Representação do modelo
chave-fechadura, por
Fischer
Enzimas
Assim, temos a equação:
E + S ↔ ES ↔ EP ↔ E + P
Estado
intermediário
O sinal ↔ indica a representação
gráfica do curso energético seguido
As enzimas são ESPECÍFICAS para
diferentes substratos
Composição
das enzimas
Natureza Enzimática
Proteínas!!!
Carboxila ou C-terminal
Por ligações peptídicas entre
monômeros (aminoácidos);
Dispostos em longa cadeia;
H H O
H–N–C–C–O–H
A variação da cadeia lateral
determina um dos 20 tipos de
proteínas
R
Amino ou N-terminal
Radical R – cadeia lateral variável
Natureza Enzimática
Mas será que todas as enzimas são proteínas? NÃO!!!!
RNAs catalíticos ou ribozimas
Participam do corte de moléculas
do RNA mensageiro (splicing),
removendo regiões que não são
traduzidas (íntrons)
Acredita-se que a peptiltransferase seja uma ribozima,
participando da formação de
ligaões peptídicas durante o
processo de tradução das
proteínas
Estrutura
Hemoglobina
Estrutura das enzimas
Como estudado anteriormente, cada aminoácido apresenta um grupo
amino, um grupo carboxila e cadeia lateral associada ao carbono
central....
...e ainda existem 20 tipos
diferentes
de
aminoácidos....
Estrutura das
enzimas
OH
O
O
C
CH2
CH2
Cadeia
principal
CH2
CH2
CH2
CH
S
CH3
H3C
CH3
...onde cada aminoácido se liga
ao
próximo
por
ligações
peptídicas e define a cadeia
principal
= formato linear
Estrutura das enzimas
Estrutura
quaternária
Como as enzimas se estruturam?
Estrutura secundária: Alfa hélice
Como as enzimas se estruturam?
Estrutura secundária: Folhas Beta
Estrutura das enzimas
Quimiotripsina
Sítio
ativo
Nas enzimas há uma região
denominada sítio ativo
É esta região que interage
com o substrato para
formação do produto
A ligação E- S ocorre entre
aminoácidos específicos
Conceito Enzima-substrato
Modelos de Encaixe Enzima Substrato
Sítio Ativo
É a região na enzima onde
o substrato se liga
É composto por resíduos
que catalisam o substrato
em produto e quebram
ligações
A união enzima-substrato
ocorre por ligações fracas
e promove a formação do
estado de transição –
primeira etapa da catálise
enzimática
Sítio Ativo
Como ocorre a ligação enzima-substrato?
Enzimas – Tipos de Encaixe
Enzima e
substrato
possuem igual
conformação
Modelo Chave-fechadura
S
E
ES
EP
P
E
Enzimas – Tipos de Encaixe
Modelo Chave-fechadura
Enzimas – Tipos de Encaixe
Modelo encaixe induzido
A enzima se
ajusta ao modelo
do substrato
S
E
ES
ES
P
E
EP
Enzimas – Tipos de Encaixe
Modelo encaixe induzido
Fosforilação em
resíduo de glicose
Como as enzimas funcionam?
Funcionamento das enzimas
Algumas enzimas necessitam de
compostos químicos associados –
COFATORES
Ex. alguns íons metálicos
Cofator
Sítio
Catalítico
Funcionamento das enzimas
Já outras enzimas necessitam de
complexos orgânicos ou
metalorgânicos associados –
COENZIMAS
Cofator
Coenzima
FAD
NAD+
FADH2
NADH
Funcionamento das enzimas
Diferente das coenzimas, os GRUPOS
PROSTÉTICOS são subgrupos de
cofatores associados permanentemente à
enzima e, geralmente, encontrados
ligados ao sítio ativo
Ex. Fe+2 no centro catalítico da molécula
de hemoglobina
Funcionamento das enzimas
APOENZIMA
HOLOENZIMA
Enzima (SEM cofatores): APOENZIMA
Enzima (COM cofatores e coenzima):
HOLOENZIMA
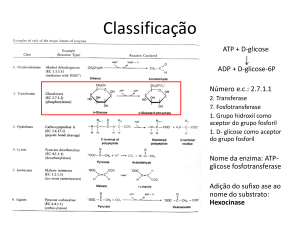
Classificação das Enzimas
As enzimas podem ser divididas em 6
classes!
Ligases
Isomerases
Liases
Hidrolases
Transferases
Óxido-redutases
Classificação
Óxido-redutase
Catalisam reações
de transferência
de elétrons
Desidrogenase,
oxidase..
Transferase
Catalisam a
Acil, amino...
transferência de
parte do substrato
para o produto
Transferência de
grupos funcionais
entre doadores e
aceptores
Hidrolase
Catalisam a
quebra pela água
O grupo doador é
transferido para
água
Fosfatase,
enolase...
Classificação
Liase
Catalisam a
quebra ou união
de cadeia
carbônica, água
ou amônia
Descarboxilase,
sintase,..
Isomerase
Realizam a troca
de posição dos
grupamentos
(rearranjos)
Epimerase,..
Ligase
Catalisam a união Carboxilase,
entre moléculas, sintetase,..
onde há gasto de
ATP, estruturando
uma cadeia
A
IMPORTÂNCIA
DAS ENZIMAS
Algumas enzimas são utilizadas como marcadores sorológicos
Enzimas
Principal Fonte
Aplicações Clínicas
Amilase
Glândulas salivares,
pâncreas
Doenças
pancreáticas
Aminotransferase
Fígado, músculo
esquelético, rim,
coração
Infarto do miocárdio,
doença muscular
Creatina Cinase
Cérebro, coração
Infarto do miocárdio
Fosfatase Ácida
Próstata
Câncer de próstata
Fosfatase Alcalina
Fígado, osso,
placenta
Doenças ósseas
γGlutamiltransferase
Fígado
Enfermidade
hepatobiliar
ocasionada por
alcoolismo
Lactato
Desidrogenase
Eritrócitos,
plaquetas, coração
Hemólise, infarto do
miocárdio
Algumas enzimas são utilizadas como marcadores sorológicos
Infarto do Miocárdio
Isoenzimas
• Enzimas que diferem
em suas sequências
de aminoácidos mas
catalisam a mesma
reação
• Normalmente
possuem parâmetros
cinéticos diferentes
• Confere maior
especificidade ao
diagnóstico.
Fenilcetonúria
Mutação do gene da fenilalanina
hidroxilase >
acúmulo
Acúmulo de fenilalanina no sangue
Aumento da excreção urinária de ácido
fenilpirúvico e fenilalanina
A fenilalanina compete com outros aminoácidos neutros e aromáticos pelo
transporte através da barreira hematoencefálica. Se ela está em excesso o
transporte dos outros aminoácidos é prejudicado.
Como as enzimas funcionam?
Como as enzimas funcionam?
Reação espontânea
alta energia de ativação livre
aumento do tempo para atingir o estado
de transição
Reação catalisada por enzimas
baixa energia de ativação livre
tempo reduzido para atingir o estado de transição
aumento da velocidade da reação
Como as enzimas funcionam?
A concentração dos substratos +
a concentração de produtos
formados determina a velocidade
que ocorre a reação
Enzimas são capazes de
alterar a velocidade de
reação, mas não o
equilíbrio químico
A interação fraca (intermediária)
enzima-substrato é reajustada
Ocorre quase imperceptível e muito
rápido
Com o reajuste, temos enzimaproduto
E+S
A ligação enzima-substrato é
dependente da especificidade
↔ ESES↔EPEP ↔ E + P
Ligação
intermediária
As enzimas são
específicas a
cada tipo de
substrato
Especificidade deriva da formação de muitas interações fracas
entre a enzima e a molécula específica do substrato.
Como as enzimas funcionam?
Após o substrato se ligar à enzima,
há presença de energia livre alta
A diferença entre o estado de
energia livre na etapa intermediária
e o substrato é chamado de
energia livre de ativação de
‡
Gibbs ( ∆ G )
Com a interação
enzimática, a barreira
imposta durante o
estado de transição é
vencida
As enzimas reduzem a
energia de ativação livre,
facilitando a interação
com o substrato para
gerar a etapa
intermediária
Bioquímica (Stryer)
Com a redução da energia
livre de ativação, há um ganho
de tempo, acelerando a
formação do produto.
Como as enzimas funcionam?
Sem ação enzimática, a
formação do produto
demanda mais tempo
Ao final, a quantidade
de produto gerado será
igual tanto na reação
espontânea quanto na
reação enzimática
Bioquímica (Stryer)
Por que com o passar do tempo
a velocidade de formação do
produto se estabiliza?
Por quê? A enzima
catalisa, mas não
participa da formação
do produto (não é
consumida para que o
produto seja formado)
A reação atingiu o equilíbrio químico (ou ponto de
saturação) – [ ] de substrato convertida em produto
Mecanismos de
Catálise
Mecanismos de catálise
Existem basicamente três formas como as enzimas aceleram
reações, aumentando a formação das moléculas de um
substrato quando em estado de transição:
Catálise ácido-base
Catálise covalente
Catálise por íon
metálico
Mecanismos de catálise
Catálise ácido-base
Quando há doação ou liberação
de prótons (H+) a fim de
estabilizar a ligação
intermediária
Mecanismos de catálise
Mecanismos de catálise
Catálise covalente
Ligações fortes
Compartilhamento de um par
de elétrons entre átomos
adjacentes
Resulta na ligação covalente
entre enzima-substrato e induz
sua transformação em produto
Frutose 2,6bifosfatase
Mecanismos de catálise
Catálise covalente
Há vários tipos de alterações
covalentes, sendo a fosforilação a
mais comum
Outras alterações:
Adenilação, acetilação,
ubiquitinização, metilação,..
Mecanismos de catálise
Catálise por íons
metálicos
Estabilizam íons em estado de transição (cálcio, magnésio e zinco)
O íon encontra-se firmemente ligado ao aminoácido no sítio ativo,
interagindo com a enzima e o substrato
Covalente
Algumas enzimas
utilizam duas
estratégias de
catálise ao
mesmo tempo
Ex.
quimiotripsina
AcidoBase
atividade enzimática
atividade enzimática
Efeito do pH na atividade
enzimática
pH
A ionização de AA pode provocar modificações
na conformação da enzima.
pH > pI
•pH do meio está alcalino;
•concentração reduzida de íons H+ no meio;
•os aa liberam H+, ficando eletricamente negativo.
pH < pI
•pH do meio está ácido;
•excesso de íons H+ no meio;
•os aa recebem H+, ficando eletricamente positivo.
Efeito da temperatura na atividade
enzimática
quimiotripsina de porco
enzima isolada de um camarão do Alaska
enzima isolada de uma bactéria de fontes termais
V initial varia com a CONCENTRAÇÃO DE SUBSTRATO
k1
k2
k-1
Subst r at o (m M )
0,2
0,4
0,8
1,0
2,0
4,0
6,0
V ( m m ol .l -1 .m i n -1 )
5,0
7,5
1 0,0
1 0,7
1 2,5
1 3,6
1 3,5
V = k . [ S ]
Livros recomendados