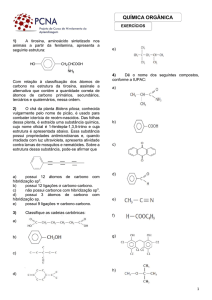
Isomeria: Substâncias diferentes que
apresentam a mesma composição
Disciplina: Química
Professor: Rubens Barreto
III Unidade
O que são isômeros?
Compostos distintos, com propriedades diferentes que
possuem a mesma fórmula molecular, mas diferem entre si
em suas fórmulas estruturais.
34
Tipos de isomeria
Isomeria de função
Ocorre quando os isômeros pertencem a funções orgânicas
diferentes.
Isomeria de cadeia ou constitucional
Ocorre quando os isômeros pertencem a mesma função
orgânica, mas, apresenta diferenciação na cadeia principal.
Principais exemplos:
- Isomeria entre cadeia aberta não ramificada e cadeia
aberta ramificada:
H3C-CH2-CH2-CH3
e
H3C-CH-CH3
CH3
-Isomeria entre cadeia fechada e aberta:
1)
2)
- Isomeria entre cadeia fechada não ramificada e
ramificada:
Isomeria de posição
Neste caso, os compostos apresentam a mesma massa
molecular, pertencem ao mesmo grupo funcional, possuem
a mesma cadeia principal, mas se diferenciam quanto à
posição de um grupo funcional, de um radical ou de uma
isomerização.
-Diferente posição do grupo funcional:
H3C-CH-CH3
OH
e
H3C-CH-CH3
OH
Quanto a posição do radical:
Quanto à posição da insaturação:
Ácidos Graxos
organismo
fundamentais
ao
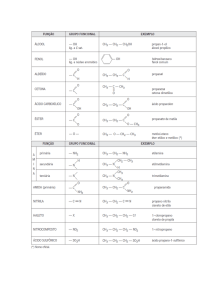
Isomeria de compensação ou metameria
São isômeros de mesma função química, com cadeias
heterogêneas, que diferem pela localização do heteroátomo nas
cadeias.
H3C – O – CH2 – CH2 – CH3
H3C – CH2 – CH2 – NH - CH3
e
e
H3C – CH2 – O – CH2 – CH3
H3C – CH2 – NH -CH2 –CH3
O problema das “dioxanas”
O
aparecimento
de
metâmeros pode ocorrer
em alguns cosméticos
como xampus, cremes
dentais, enxaguantes bucais
e desodorantes. Eles são
conhecidos como dioxanas,
diéteres cíclicos que se
apresentam de três formas
isômeras:
Fonte:
Revista
IstoÉ.
Disponível
em
http://www.istoe.com.br/reportagens/91829_EM+BUSCA+DE+COS
METICOS+MAIS+SEGUROS. Acesso em 26/10/15
Tautomeria – um caso particular de isomeria funcional
Os isômeros pertencem a funções químicas diferentes, com a
característica de um deles ser mais estável que o outro.
Eles coexistem em solução aquosa, mediante equilíbrio dinâmico
no qual um isômero se transforma em outro pela transposição
intermolecular simultânea de um átomo de hidrogênio e uma
dupla ligação.
Esteroisomeria ou isomeria espacial
Neste caso, os isômeros têm a mesma fórmula molecular e
fórmula espacial diferente.
Existem dois casos de isomeria espacial:
- Geométrica ou Cis – Trans
- Óptica.
Isomeria Geométrica
Um composto apresenta isomeria geométrica ou cis-trans
quando:
a) tiver dupla ligação carbono-carbono
b) tiver ligantes diferentes a cada carbono da dupla ligação.
No isômero cis, os ligantes iguais ficam do mesmo lado do plano
da dupla ligação. No isômero trans, os ligantes iguais ficam em
lados opostos ao plano da dupla.
Não são isômeros
São isômeros
Os isômeros cis-trans apresentam propriedades físicas diferentes.
As propriedades químicas dos isômeros cis-trans são iguais.
Isomeria geométrica em compostos cíclicos
Nos compostos cíclicos é necessário que dois dos átomos de
carbono no anel possuam, ligados a eles, grupos diferentes entre
si.
40
Isomeria óptica
A isomeria óptica estuda os compostos (isômeros) opticamente
ativos que possuem mesma fórmula molecular, mas que se
diferenciam pelo tipo de desvio do plano de luz polarizada.
As moléculas desses compostos não apresentam plano de
simetria. Para saber se uma molécula apresenta isomeria óptica,
é necessário comparar sua estrutura com a estrutura
determinada por sua imagem diante de um espelho. Se elas não
se sobrepõem, a substância apresenta isomeria óptica.
A isomeria espacial óptica é aquela que apresenta um carbono
com quatro ligantes diferentes entre si. Para este carbono
damos o nome de assimétrico ou Quiral. Está identificado com
um asterisco (*).
148
Apenas a molécula de Ácido láctico tem seu reflexo no espelho
de forma invertida, as imagens não se sobrepõem (objeto ≠
imagem). Trata-se dos isômeros ácido l-láctico e ácido d-láctico.
Essa análise é muito importante, uma vez que os aspectos
fisiológicos destes isômeros se diferenciam. O ácido l-láctico é
produto da fermentação de açúcares e o d-lático está presente
nos músculos.
Só é possível detectar a diferença destes isômeros quando os
mesmos são submetidos a um feixe de luz polarizada: eles
desviam o plano de vibração da luz.
Os enantiômeros só podem ser diferenciados pela propriedade
de desviar o plano da luz polarizada.
plano da luz polarizada???
Luz natural e luz polarizada
A luz comum (ou natural) é formada por ondas
eletromagnéticas, sendo que as ondas elétricas vibram em um
plano e as magnéticas, em outro, perpendiculares entre si.
A medida que a luz “caminha”, esses dois planos giram em torno
de seu próprio eixo de propagação, de modo que, vendo a luz
“de frente”, se pudéssemos enxergar essas vibrações, iríamos ver
algo parecido com a figura A (a seguir).
Pelo contrário, na luz polarizada, os planos de vibração elétrico
e magnético não giram, de maneira que, “vendo-a de frente”,
teríamos a figura B.
É comum representar a luz polarizada apenas por um dos
planos (figura C).
Com o espato-da-islândia (CaCO3) são produzidos prismas
especiais, que são usados na construção dos polarímetros.
Exemplo do ácido láctico;
• ácido lático dextrogiro, ácido d-lático ou ácido (+) lático;
• ácido lático levogiro, ácido l-lático ou ácido (-) lático.
Se nenhuma alteração na direção da luz é observada, é possível
que o composto seja opticamente inativo ou que haja uma
mistura com quantidades identificas de dos isômeros d e l
mistura racêmica.
Compostos com vários carbonos assimétricos diferentes
ácido α-hidróxi-β-metil-succínico.
dois carbonos assimétricos considerados diferentes entre si
porque os grupos ligados ao carbono 2 não são todos iguais aos
grupos ligados ao carbono 3. no carbono 2, além do grupo
COOH, temos o grupo OH. Enquanto no carbono 3, além do
grupo COOH, temos o CH3.
Os isômeros A e B são antípodas ópticos: um dextrogiro e o outro
levogiro. O mesmo podemos dizer de C e D.
Temos duas misturas racêmicas: A + B e C + D. Nesse caso, usamos o
termo diastereoisômeros para indicar os isômeros ópticos que não
são enantiomorfos entre si — é o caso de A e C; A e D; B e C; e B e D.
Generalizando, havendo 1, 2, 3, ... n carbonos assimétricos
diferentes, teremos 21, 22, 23, ... 2n isômeros ópticos diferentes entre
si e, consequentemente, 2n : 2 = 2n - 1misturas racêmicas diferentes
entre si.