ENZIMAS
• Enzimas são polímeros biológicos que catalisam as reações
químicas que tornam a vida possível como a conhecemos.
• A presença e a manutenção dum conjunto completo e
balanceado de enzimas é essencial na digestão dos
nutrientes para o fornecimento de energia e de estruturas
bioquímicas.
• Essas estruturas serão depois sintetizadas em proteínas,
DNA, membranas, células e tecidos.
• A energia produzida será necessária para fornecer a
potência para a mobilidade celular e contração muscular.
• Com a exceção de algumas moléculas catalíticas de RNA a
grande
maioria
dos
enzimas
são
constituídos
por
proteínas.
• As deficiências na quantidade ou na atividade catalítica dos
enzimas chave resultam das deficiências genéticas, défices
nutricionais ou toxinas.
• Os enzimas com defeitos podem ser resultado, também, de
mutações genéticas, infeções virais ou genes patológicos
de batérias.
ENZIMAS SÃO CATALISADORES ALTAMENTE
ESPECÍFICOS
• Os enzimas que catalisam a conversão de um ou mais
compostos (substratos) em um ou mais diferentes
compostos (produtos), aumentam as velocidades de
reação em 105 a 1017 vezes superior à velocidade da
mesma reação não-catalisada.
• Como todos os catalisadores, os enzimas não são
consumidos ou permanentemente alterados como
consequência da sua participação na reação.
• Especificidade muitíssimo elevada, que tem a ver com
a natureza do substrato e dos produtos finais da
reação; o enzima “reconhece” o seu substrato e
catalisa a sua reação de tal forma que raramente são
formados produtos laterais (indesejados) da reação.
• Os enzimas são as biomoléculas mais importantes em
qualquer processo bioquímico.
• Catalisam
centenas
de
passos
reacionais
que
degradam as moléculas de nutrientes, conservam e
transformam
a
energia
química
e
produzem
macromoléculas a partir de percursores simples.
• Na ação dos enzimas regulatórios, os percursos
metabólicos
são
muito
bem
coordenados
para
realizarem uma convivência harmoniosa das muitas
atividades necessárias para a sustentação da vida.
PROPRIEDADES DOS ENZIMAS
• Condições mais suaves de reação, ou seja, as
condições em que reações catalisadas por enzimas são
médias: temperaturas abaixo dos 100ºC, pressão
atmosférica e pH próximo do fisiológico.
• Capacidade de regulação: a atividade catalítica de
muitas enzimas varia de acordo com a concentração de
substrato.
• Os
mecanismos
de
regulação
incluem
controlo
alostérico, modificação covalente de enzimas e variação
da quantidade de enzima sintetizada.
• A atividade catalítica depende da integridade da
conformação da proteína nativa. Se um enzima
for desnaturado ou dissociado nas suas
subunidades
a
atividade
catalítica
é
normalmente perdida.
• Se um enzima é dissociado nos seus
aminoácidos, a sua atividade catalítica é sempre
destruída.
• As estruturas primária, secundária, terciária e
quaternária dos enzimas proteicos são
essenciais para a sua atividade catalítica.
ENZIMAS FACILITAM O DIAGNÓSTICO
DE DOENÇAS GENÉTICAS
• Muitas doenças são há muito tempo conhecidas
como resultado das alterações no DNA de cada
indivíduo, as ferramentas para a deteção das
mutações genéticas somente estão recentemente
disponíveis mundialmente.
• Estas técnicas estão baseadas na eficiência e
especificidade catalítica dos enzimas. Por exemplo,
a reacção em cadeia da polimerase (PCR) baseiase na habilidade dos enzimas servirem de
amplificadores da análise de DNA presente nas
amostras biológicas e forences.
ENZIMAS UTILIZADOS EM DIAGNÓSTICOS
CLÍNICOS
COFATORES E COENZIMAS
• Os grupos funcionais das proteínas podem
facilmente participar em reações ácido/base,
formando certos tipos de ligações covalentes e
tomam parte nas interações carga/carga.
• São assim piores para catalisar reações redox
mas, apesar disso, os enzimas catalisam estas
reações,
graças
à
associação
nestas
de
pequenas moléculas, cofatores, que agem
como “dente químico” do enzima.
Um coezima ou metal iónico que está
covalentemente ligado ao enzima é
chamado grupo prostético.
Um enzima completo, catalíticamente
ativo, juntamente com o ser coezima/
ou ião metálico é chamado de
holoenzima.
A parte proteica é designada de
apoenzima ou apoproteína.
Os
coezimas
atuam
como
percursores transientes dos grupos
funcionais específios. A maioria são
derivados de vitaminas (nutrientes
orgânicos necessários em pequenas
quantidades na dieta humana).
CLASSIFICAÇÃO DOS
ENZIMAS
COENZIMAS TÊM QUE SER
REGENERADOS
• Os coenzimas são alterados quimicamente pela
reação enzimática em que participam. Assim, para
completar o ciclo catalítico, o coenzima tem de
voltar ao seu estado inicial. Nos grupos prostéticos
a regeneração ocorre numa fase separada da
sequência da reação enzimática.
• Muitos organismos não são capazes de sintetizar
certos coenzimas. Assim, essas substâncias têm de
estar presentes na dieta do organismo.
• Certas vitaminas estão assim nesta lista de
coenzimas e a sua carência pode provocar uma
série de doenças provocadas por catálises
enzimáticas incompletas.
MECANISMOS CATALÍTICOS
• Os enzimas, baixam a energia de ativação duma
determinada reação.
• O que as torna tão eficientes é o fato de terem uma
enorme especificidade de ligação ao substrato,
combinada com o arranjo dos seus grupos
catalíticos e com a combinação de vários
mecanismos catalíticos.
• Existem assim seis grupos de catálises empregues
pelos enzimas.
DIMINUIÇÃO DA ENERGIA DE ATIVAÇÃO
CATÁLISE ÁCIDO-BASE
• A catálise ácida é, geralmente, um processo no qual protões parciais se
transferem de um ácido e vão baixar a energia de transição de uma reação.
• Muitas reações bioquímicas são suscetíveis a catálise ácido-base; as
cadeias laterais de alguns resíduos proteicos possuem pK’s perto do pH
fisiológico, que vai assim permitir que ajam como catalisadores ácidos ou
básicos. Assim, a habilidade dos enzimas em arranjarem vários grupos
catalíticos em volta do seu substrato, faz com que a catálise ácido-base seja
um mecanismo de catálise enzimática bastante comum. Logo, vem que a
atividade catalítica destas enzimas é sensível ao pH, já que o pH influencia o
estado de protonação das cadeias laterais do centro ativo.
CATÁLISE COVALENTE
• A catálise covalente acelera a reação através da
formação de uma ligação covalente catalisadorsubstrato.
• Normalmente esta ligação covalente é formada pela
reação de um grupo nucleófilo catalisador com um
eletrófilo no substrato.
• A catálise covalente pode ser decomposta em três
partes:
1. A reação nucleófila entre o catalisador e o substrato
para formar uma ligação covalente;
2. A troca de eletrões do centro da reação com o agora
eletrofílico catalisador;
3. A eliminação do catalisador, uma reação que é
essencialmente a inversa de 1.
CATÁLISE METAL-IÓNICA
• Perto de um terço de todos os enzimas conhecidos
necessitam da presença de iões metálicos para a
atividade catalítica. Este grupo de enzimas inclui as
metaloenzimas que contêm como cofatores iões
metálicos (como o próprio nome indica).
• Os enzimas metal-ativados, em contraste, ligam
metais iónicos de soluções, normalmente metais
alcalinos ou alcalino-terrosos.
• Os iões metálicos participam no processo
catalítico de três formas principais:
1. Ligando-se aos substratos, de maneira a
orientá-los adequadamente para a reação;
2. Permitindo reações redox, através de
mudanças reversíveis nos seus estados de
oxidação;
3. Através de estabilização eletrostática ou
“blindando” cargas negativas.
CATÁLISE ELETROSTÁTICA
• A ligação de um substrato geralmente exclui a água
do centro ativo dum enzima. Assim, pode dizer-se
que o centro ativo tem as caraterísticas polares dum
solvente orgânico, onde as interações eletrostáticas
são muito mais fortes que numa solução aquosa.
• As distribuições de carga à volta do centro ativo de
um enzima estão arranjadas de maneira a
estabilizar os estados de transição das reações
catalisadas.
• Por outro lado, em muitos enzimas as distribuições
das cargas vão, aparentemente, guiar substratos
polares aos sítios da ligação, aumentando assim a
velocidade da reação.
CATÁLISE ATRAVÉS DE PROXIMIDADE E
EFEITOS DE ORIENTAÇÃO
• Os efeitos mais óbvios são proximidade e orientação: os
reagentes têm de se “unir” ao enzima com a relação
espacial própria, de forma a poder dar-se a reação.
Assim, por simplesmente ligarem os seus substratos, os
enzimas facilitam a reação em três aspetos:
1. Os enzimas levam os substratos ao contato com os seus
grupos catalíticos;
2. Os enzimas ligam os seus substratos na orientação
adequada para a reação;
3. Os enzimas param as deslocações de translação e rotação
dos substratos e grupos catalíticos. Este aspeto é importante
pois favorece o aparecimento do estado de transição, onde
os movimentos relativos aos compostos são mínimos.
CATÁLISE POR PREFERÊNCIA DE
LIGAÇÃO E DE ESTADO DE TRANSIÇÃO
• Um enzima pode ligar o estado de transição da
reação que catalisa com maior afinidade que os
substratos ou produtos.
• Assim, os enzimas que se ligam preferencialmente
ao estado de transição aumentam a concentração
deste, aumentando assim proporcionalmente a
velocidade da reação.
• Por este fato, os estados de transição análogos são
inibidores da reação, uma vez que o enzima os
“agarra” como se fossem a molécula a catalisar,
inativando-a.
• Acontece por vezes que estes análogos tenham
maior afinidade com o enzima do que a molécula
que pretendemos catalisar.
MECANISNO DA
HEXOCINASE
CINÉTICA ENZIMÁTICA
• Geralmente, a velocidade de catálise (V) varia com a
concentração do substrato [S]. De tal forma que, para uma
concentração fixa de enzima, V é quase linearmente proporcional a
[S], quando [S] é pequena. Por outro lado, quando a concentração
[S] tem valores elevados, velocidade de catálise é praticamente
independente de [S]. O modelo proposto por Michaelis-Menten
explica as propriedades cinéticas dos enzimas.
Progressão das curvas para uma reação simples catalisada por um enzima. Com exceção da
fase inicial da reação, os declives das curvas de [E] e [ES] são essencialmente zero enquanto
[S] >>[E].
• Um enzima, E, combina-se com o substrato, S, para formar o complexo
ES, com uma constante de velocidade K1. O complexo ES pode
dissociar-se em E e S, com uma constante de velocidade K2, ou pode
prosseguir para formar o produto, P, com uma constante de dissociação
K3. A equação que explica as propriedades cinéticas das enzimas é a
equação de Michaelis-Menten.
sendo Km=(K2+K1)/K3 a constante de Michaelis.
Quando a concentração de substrato S é igual ao valor de Km, a velocidade de
reação é metade da sua velocidade máxima; isto é, V=½ Vmáx.
Quando a concentração de substrato S é igual ao valor de Km, a
velocidade de reação é metade da sua velocidade máxima; isto é,
V=½Vmáx.
O gráfico de V0 (velocidade inicial) de uma reação enzimática simples vs [S]
CÁLCULO DE Vmax E Km
• Os valores de Vmáx e Km podem ser determinados fazendo variar a
concentração de [S] a partir da linearização de Lineweaver-Burk, a
qual transforma a equação de Michaelis-Menten num gráfico em
linha reta de 1/V em função de 1/[S] , o qual interseta o eixo de 1/V
no ponto 1/Vmáx com uma inclinação de Km/Vmáx.
“TURNOVER NUMBER”
• É equivalente ao número de moléculas de substrato convertido em produto
num certo perídodo de tempo numa molécula de enzima quando este encontrase saturado com substrato.
• A melhor maneira para comparar as eficiências catalíticas de enzimas
diferentes ou o “turnover” de substratos diferentes pelo mesmo enzima é a
comparação do racio kcat/Km para duas reações. Este parâmetro, é às vezes
chamado de constante específica, é a constante de velocidade para a
conversão de [E] +[ S] para [E] +[ P]. Quando [S] <<Km:
V0 depende da concentração dos dois reagentes, [Et] e [S].
ENZIMAS CATALISAM REAÇÕES COM
DOIS OU VÁRIOS SUBSTRATOS
• Reações enzimáticas com dois substratos normalmente envolvem a
transferência de um átomo ou um grupo funcional de um substrato
para outro. Estas reações procedem num ou diferentes passos.
Nalguns casos, os dois substratos estão ligados ao enzima formando
um complexo terciário não covalente.
Mecanismo Ping-Pong
INIBIÇÃO ENZIMÁTICA
• Os inibidores enzimáticos são agentes moleculares que
interferem com a catálise, alterando ou tornado as
reações enzimáticas mais lentas.
• Os enzimas catalisam praticamente todos os processos
celulares.
• Não é de surpreender que os inibidores enzimáticos são
os agentes farmacológicos mais importantes.
• Por exemplo, a aspirina (ácido acetilsalicílico) inibe o
enzima que catalisa o primeiro passo da síntese de
prostaglandis, compostos que estão involvidos em
muitos processos, incluindo alguns que provocam a dor.
• Os enzimas podem sofrer dois tipos de inibição:
1.Inibição irreversível, na qual o inibidor se
dissocia muito lentamente do “enzima-alvo”;
2. Inibição reversível, que é caraterizada por uma
dissociação rápida do complexo enzima-inibidor.
INIBIÇÃO COMPETITIVA
• O enzima pode ligar-se ao substrato (formando um complexo ES) ou
ao inibidor (formando o complexo EI), porém nunca se pode ligar aos
dois (ESI).
• Um inibidor competitivo é semelhante ao substrato, ligando-se ao
centro ativo do enzima, impedindo assim que o substrato se ligue ao
centro ativo do enzima. Portanto, este tipo de inibidor diminui a
velocidade de catálise, reduzindo a proporção de moléculas de
enzima ligados a um substrato.
INIBIÇÃO NÃO COMPETITIVA
• O substrato e o inibidor podem ligar-se ao enzima em simultâneo.
Então, um inibidor não competitivo age pela diminuição do número
de renovação, em detrimento da diminuição da quantidade de
complexos ES.
INIBIÇÃO MISTA
• Um inibidor tanto afeta a ligação do substrato,
quanto altera o número de renovação.
INIBIÇÃO IRREVERSÍVEL
• Os inibidores irreversíveis são aqueles que
ligam-se covalentemente ou destroem o grupo
funcional (essencial para a atividade catalítica)
dum enzima, ou aqueles que formam uma
associação não covalente particularmente
estável sendo este processo é muito comum.
• Os inibidores irreversíveis são ferramentas muito
úteis para o estudo de mecanismos reacionais
dos enzimas. Aminoácidos com funções
catalíticas chave no centro ativo podem ser
identificados para a determinação do resíduo
que está covalentemente ligado ao inibidor após
o enzima se encontrar desativado.
INFLUÊNCA DO pH NA ATIVIDADE
ENZIMÁTICA
• A atividade catalítica aumenta, à medida que o pH aumenta. No
entanto, ao atingir um determinado valor de pH, a atividade catalítica
atinge o seu máximo - pH óptimo. A partir deste valor de pH, a
atividade catalítica dos enzimas começa a diminuir, dado que valores
pH muito elevados originam a desnaturação das proteínas.
Gráficos da influência do pH na atividade enzimática
INFLUÊNCA DA TEMPERATURA NA
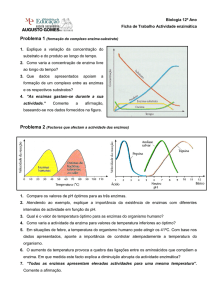
ATIVIDADE ENZIMÁTICA
• À medida que a temperatura aumenta, a atividade catalítica aumenta
também, até atingir um determinado valor - Temperatura Óptima. A
partir desta temperatura, que corresponde ao valor máximo de atividade
enzimática, a atividade catalítica começa a diminuir, pois, a
temperaturas elevadas inicia-se a desnaturação térmica das proteínas.
Gráfico da influência da Temperatura na atividade enzimática
REGULAÇÃO DAS ATIVIDADES
• Apesar da existência de oscilações de curto prazo nas
concentrações dos metabolitos e níveis de enzimas, as
células vivas permanecem num estado dinâmico onde
as
concentrações
médias
dos
intermediários
metabólicos permanecem relativamente constantes ao
longo do tempo.