Aminoácidos e proteínas
1. Origem:
Origem: tecido vegetal ⇒ substâncias
inorgânicas (nitrogenadas)
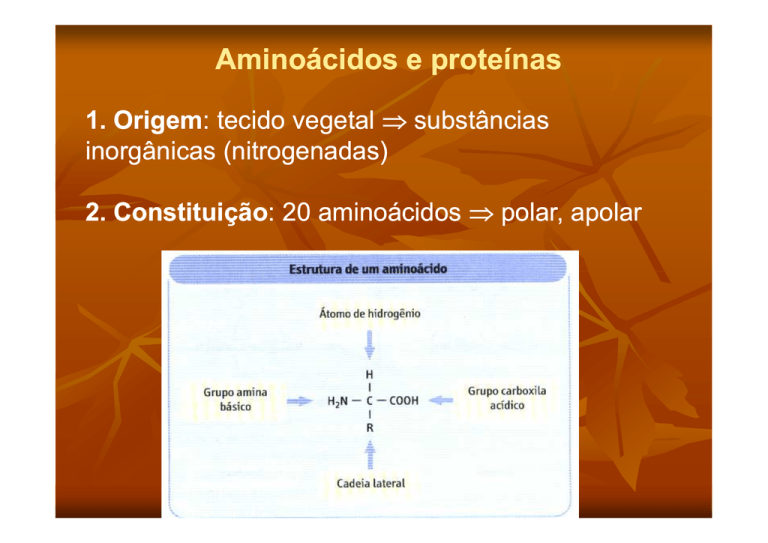
2. Constituição:
Constituição: 20 aminoácidos ⇒ polar, apolar
- centro quiral
- 16% nitrogênio = fator 6,25
- substâncias anfóteras = zwitterion
⇓
solução tampão: H2CO3 ↔ H+ + HCO3H2PO4- ↔ H+ + HPO4-2
- nomenclatura: IUPAC
- ligação peptídica: ligação covalente
- aminoácidos essenciais: treonina, triptofano,
isoleucina, leucina, valina, lisina, metionina,
fenilalanina, histidina
- aminoácidos limitantes: critérios da FAO e OMS
3. Importâncias biológicas
- fornecer aminoácidos e proteínas ao organismo
- transporte de substâncias
- construção e manutenção dos tecidos e órgãos
- formação de enzimas, hormônios e anticorpos
- fornecimento de energia
4. Estruturação das proteínas
- estrutura primária ⇒ ligação peptídica
- estrutura secundária ⇒ α hélice e folha
pregueada (pontes de hidrogênio)
- estrutura terciária ⇒ globular e fibrosa
- estrutura quaternária ⇒ associação = função
biológica
5. Classificação
-proteínas simples = aminoácidos
⇒ albuminas, globulinas, glutelinas, histonas,
Albuminóides
- proteínas conjugadas = aminoácidos + grupo
prostético
⇒ nucleoproteínas, glicoproteínas,
fosfoproteínas, cromoproteínas, lipoproteínas,
metaloproteínas
6. Desnaturação protéica:
protéica: desorganização
estrutural (reversível ou irreversível)
- agentes desnaturantes físicos: calor, frio, agitação
mecânica, radiação
- agentes desnaturantes químicos: álcool, sais de
metais pesados, solução salina, pH
7. Digestão/ absorção
estômago ⇒ pepsina + suco gástrico
⇓
Intestino delgado ⇒ tripsina + quimiotripsina
⇓
carboxipeptidases, aminopeptidases
Absorção ⇒ aminoácios livres ou dipeptídeos
⇓
Fígado ⇒ órgão regulador












