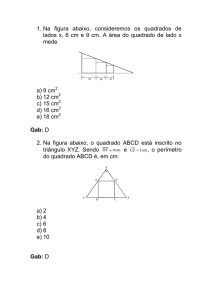
Professor • Duda
Aluno (a): _____________________________________
01 - (UEG GO)
Durante a manifestação das reações químicas, ocorrem variações de
energia. A quantidade de energia envolvida está associada às
características químicas dos reagentes consumidos e dos produtos
que serão formados.
O gráfico abaixo representa um diagrama de variação de energia de
uma reação química hipotética em que a mistura dos reagentes A e B
levam à formação dos produtos C e D.
Com base no diagrama, no sentido direto da reação, conclui-se que a
a)
energia de ativação da reação sem o catalisador é igual a 15kJ.
b)
energia de ativação da reação com o catalisador é igual a 40kJ.
c)
reação é endotérmica.
d)
variação de entalpia da reação é igual a -30kJ.
02 - (UNIFOR CE)
A amônia é um produto básico para a produção de fertilizantes
produzida cataliticamente, em altas pressões, conforme a reação:
N2 (g) + 3H2 (g) 2NH3 (g).
Realizou-se esta reação sob três diferentes condições experimentais,
todas partindo da mesma concentração de gás nitrogênio e
hidrogênio. A variação da concentração de amônia formada foi
registrada em função do tempo conforme o gráfico abaixo.
e)
06
27/03/2013
Química
Nos três experimentos após o término da reação, foi obtida a
mesma quantidade de amônia.
03 - (IFGO)
No gráfico abaixo, estão representadas as variações das
concentrações, durante os primeiros 50 segundos, das substâncias A,
B, C e D, que participam de uma reação hipotética.
A partir da análise do gráfico, é correto afirmar que:
a)
As substâncias A e C são reagentes da reação.
b)
No intervalo de 40 a 50 segundos de reação, a velocidade de
formação de C é maior que a velocidade de consumo de D.
c)
Nenhum produto se encontra presente no início da reação.
d)
A mistura das substâncias A e D resulta na produção de B.
e)
As substâncias A, B e D estão presentes no início da reação.
04 - (UFG GO)
A água oxigenada comercial é uma solução de peróxido de
hidrogênio (H2O2) que pode ser encontrada nas concentrações de 3,
6 ou 9% (m/v). Essas concentrações correspondem a 10, 20 e 30
volumes de oxigênio liberado por litro de H2O2 decomposto.
Considere a reação de decomposição do H2O2 apresentada a seguir:
2 H2O2 (aq) 2 H2O (aq) + O2 (g)
Qual gráfico representa a cinética de distribuição das concentrações
das espécies presentes nessa reação?
Com base no gráfico, é CORRETO afirmar que:
a)
No experimento 1, a velocidade média de reação nos primeiros
10 minutos foi de 1,5 mol/min.
b)
No experimento 2, foi utilizado um catalisador, pois aumentou
significativamente a velocidade de reação em relação aos
demais experimentos.
c)
No experimento 3, a temperatura da reação foi superior, pois
diminuiu a velocidade média da reação.
d)
O experimento que obteve a maior velocidade média de
reação nos primeiros 5 minutos foi o que obteve um maior
rendimento.
www.cursosimbios.com.br
a)
b)
c)
d)
e)
1
05 - (UFT TO)
Em experimento para obtenção do gás hidrogênio, o aluno adicionou
um pedaço de fita de magnésio a uma solução aquosa de ácido
clorídrico, e observou o consumo da fita e a formação do gás
hidrogênio.
Para este experimento, qual dos gráficos abaixo melhor representa o
comportamento dos íons na solução durante o processo. Considere t
= tempo em minuto e concentração [ ] = mol/L
a)
A respeito desse diagrama, é INCORRETO afirmar que
a)
a diferença entre os valores de energia, representados pelas
letras A e B, corresponde à diminuição da energia de ativação
do processo, provocada pelo uso de um catalisador.
b)
o valor de energia representado pela letra C identifica a
entalpia do produto.
c)
o valor de energia representado pela letra D se refere à
entalpia dos reagentes.
d)
a diferença entre os valores de energia, representados pelas
letras A e D, corresponde à energia de ativação do processo
catalisado.
e)
a diferença entre os valores de energia, representados pelas
letras C e D, corresponde à variação da entalpia do processo.
07 - (UFTM MG)
O gráfico apresenta a variação de energia em função do sentido da
reação, para decomposição do peróxido de hidrogênio.
b)
c)
Quanto à decomposição do peróxido de hidrogênio, podemos
afirmar que:
a)
a reação é exotérmica, porque há liberação de energia.
b)
a reação ocorre com absorção de energia.
c)
na presença de um catalisador, ocorre aumento da energia de
ativação.
d)
na presença de um catalisador, ocorre diminuição do calor de
reação.
e)
o peróxido de hidrogênio é uma mistura homogênea de água e
gás oxigênio.
d)
08 - (UFSC)
Para a reação de obtenção do CH3CH2Br, têm-se as seguintes
informações:
e)
06 - (MACK SP)
O diagrama abaixo se refere a um processo químico representado
pela equação química X2(g) + Y2(g) 2 XY(g), realizado por meio de
dois caminhos reacionais diferentes, ambos nas mesmas condições
de temperatura e de pressão.
Expressão de equilíbrio:
H2C=CH2 + HBr
CH3CH2Br
Dados termodinâmicos (a 298 K):
7
Keq = 7,5 x 10
0
H = -84,1 kJ mol-1
Ea = 140 kJ mol-1
Com relação às informações acima, assinale a(s) proposição(ões)
CORRETA(S).
01. O valor de Keq indica que a formação de CH3CH2Br é favorecida.
02. Trata-se de uma reação de eliminação.
www.cursosimbios.com.br
2
04.
08.
16.
32.
O valor de H sugere que a reação é endotérmica.
O fato da reação apresentar H<0 indica que a velocidade de
obtenção do CH3CH2Br é alta.
O nome IUPAC da substância CH3CH2Br é bromoetano.
Na molécula do eteno, há duas ligações sigma C-H.
11 - (UEL PR)
As figuras X, Y e Z mostram três gráficos de energia em função do
progresso da reação. Estas figuras estão representando três reações:
R1 P1; R2 P2 e R3 P3.
09 - (UFG GO)
A reação química descreve a transformação do composto A em um
complexo ativado intermediário que, por sua vez, forma o composto
B.
A
Complexo
Ativado
B + calor
O gráfico a seguir apresenta a relação entre a energia e o caminho da
reação.
Considerando o exposto,
a)
calcule a energia de ativação e a variação de entalpia (H) da
reação.
b)
esboce um gráfico entre a energia e o caminho da reação
inversa.
10 - (USP SP)
Os gráficos a seguir mostram a presença de álcool, detectada no
sangue de 3 homens adultos, que pesam, em média, 75kg. As curvas
ilustram como seria a variação da concentração de álcool no sangue,
em função do tempo, após a ingestão de cerveja.
Escolha a alternativa que indica quanto tempo leva,
aproximadamente, para que a concentração de álcool, detectada no
sangue, volte a ser inferior a 0,1g/L, após o consumo, de forma
ininterrupta, de 2, 3 e 4 latas de cerveja, respectivamente.
Com base nas informações contidas nos gráficos, considere as
afirmativas a seguir:
I.
A energia de ativação da reação R1 P1 é menor que a
energia de ativação da reação R3 P3.
II.
Dentre as reações representadas em X e Z, a reação R3 P3 é
a mais lenta.
III.
O valor da energia de ativação das reações representadas nas
figuras X, Y e Z depende das concentrações de R1, R2 e R3.
IV. Dentre as três reações, a reação R2 P2 é a que libera maior
quantidade de energia.
Assinale a alternativa correta.
a)
Somente as afirmativas I e II são corretas.
b)
Somente as afirmativas I e III são corretas.
c)
Somente as afirmativas III e IV são corretas.
d)
Somente as afirmativas I, II e IV são corretas.
e)
Somente as afirmativas II, III e IV são corretas.
12 - (UEL PR)
A investigação do mecanismo de reações tem contribuído na
compreensão de muitos processos químicos desenvolvidos em
laboratório de pesquisa. A reação genérica A D é uma reação não
elementar e seu mecanismo está representado no gráfico a seguir:
Analise o gráfico e assinale a alternativa correta.
a)
A etapa C D é a determinante da velocidade da reação A
D.
b)
Na reação A D estão envolvidas quatro reações
elementares.
c)
No decorrer da reação ocorre a formação de seis substâncias
intermediárias.
d)
A expressão da velocidade da reação A D é v = k [A].
e)
As substâncias B e C são catalisadores da reação A D.
a)
b)
c)
d)
e)
1 hora, 1 hora e meia, 2 horas.
1 hora e meia, 2 horas, 4 horas.
2 horas, 3 horas, 4 horas.
2 horas, 4 horas, 5 horas e meia.
3 horas, 5 horas, 7 horas.
www.cursosimbios.com.br
3
13 - (UFT TO)
A seguinte reação N2O5(g)
NO2(g) + O2(g) não balanceada está
representada no gráfico abaixo, onde observa-se a concentração
mol/L em função do tempo de reação.
15 - (FUVEST SP)
Pilocarpina (P) é usada no tratamento do glaucoma. Em meio
alcalino, sofre duas reações simultâneas: isomerização, formando isopilocarpina (i – P) e hidrólise, com formação de pilocarpato (PA–) . Em
cada uma dessas reações, a proporção estequiométrica entre o
reagente e o produto é de 1 para 1.
Num experimento, a 25 ºC, com certa concentração inicial de
pilocarpina e excesso de hidróxido de sódio, foram obtidas as curvas
de concentração de i – P e PA– em função do tempo, registradas no
gráfico.
Considerando o gráfico, assim como a equação citada, é CORRETO
afirmar:
a)
C é o produto principal, portanto o de menor concentração.
b)
O reagente C é responsável pela formação dos produtos A e B.
c)
O gráfico demonstra que durante a reação o aumento dos
reagentes A e B dependem diretamente do produto C.
d)
O número de mol formado no produto é menor que número de
mol do reagente.
e)
A falta do balanceamento estequiométrico leva à não
determinação de reagentes e produtos.
14 - (UFSCAR SP)
Diversos processos industriais envolvem reações químicas, que devem
ocorrer de forma controlada e otimizada para gerar lucros. O processo
ideal deveria ser o mais rápido possível, com rendimento máximo,
consumo energético mínimo e com a menor geração de resíduos
tóxicos para a obtenção de um produto estável. Reações hipotéticas
para obtenção de um mesmo produto (P) de interesse industrial estão
representadas nos gráficos seguintes, que estão em escalas iguais para
as grandezas correspondentes. Identifique a alternativa que
corresponde à reação que no tempo t atinge a concentração máxima
de um produto estável, a partir dos reagentes R.
Considere que, decorridos 200 s, a reação se completou, com
consumo total do reagente pilocarpina.
a)
Para os tempos indicados na tabela da folha de respostas,
complete a tabela com as concentrações de i – P e PA–.
b)
Complete a tabela com as concentrações do reagente P.
c)
Analisando as curvas do gráfico, qual das duas reações, a de
isomerização ou a de hidrólise, ocorre com maior velocidade?
Explique.
16 - (UFLA MG)
Considere a reação de decomposição:
2A (g) 4B (g) + C (g)
a)
Representando em um gráfico a variação das concentrações de
reagente e produtos em função do tempo, é CORRETO afirmar que as
curvas I, II e III representam, respectivamente:
b)
c)
a)
b)
c)
d)
d)
B, A, C
B, C, A
C, B, A
A, B, C
17 - (UFCG PB)
Durante muitos anos, a gordura saturada foi considerada a grande
vilã das doenças cardiovasculares.
Agora, o olhar vigilante de médicos e nutricionistas volta-se contra a
prima dela, cujos efeitos são ainda piores: a gordura trans (que é um
composto com ligação dupla). Durante a hidrogenação catalítica que
transforma o óleo de soja em margarina, ligações duplas tornam-se
ligações simples. O gráfico a seguir representa a variação da massa da
gordura trans em função do tempo.
e)
www.cursosimbios.com.br
4
Assinale a alternativa cujo gráfico melhor descreve a cinética da
reação.
a)
Interprete o gráfico e assinale a alternativa INCORRETA.
a)
A velocidade média entre os pontos B e C é de 2 g/min.
b)
A velocidade média da reação, para um mesmo intervalo de
tempo, aumenta com a passagem do tempo.
c)
A velocidade média entre os pontos A e B é maior do que a
entre os ponto D e E.
d)
A velocidade média entre os pontos B e C é diferente da
velocidade média entre os pontos B e D.
e)
A velocidade no início da reação é diferente de zero.
18 - (UFG GO)
“A transesterificação de triglicerídeos (T) (óleo vegetal) não ocorre
em uma única etapa. Em geral, os triglicerídeos transformam-se
rapidamente em diglicerídeos e monoglicerídeos (M). Entretanto, a
conversão do monoglicerídeo em éster (E) metílico, ou etílico
(biodiesel), constitui uma etapa lenta.”
QUÍMICA NOVA, 2007, 30(5), 1374-1380.
De acordo com o texto, o gráfico que representa o perfil cinético da
transesterificação de um triglicerídeo é:
b)
c)
d)
e)
19 - (UNESP SP)
As figuras representam esquematicamente dois tempos (t) da reação
entre os gases H2 e Cl2. Nelas encontram-se representadas
pictoricamente as relações entre as quantidades das moléculas de
reagentes e produto envolvidas.
20 - (UFRJ)
A redução das concentrações de gases responsáveis pelo efeito
estufa constitui o desafio central do trabalho de muitos
pesquisadores. Uma das possibilidades para o seqüestro do CO2
atmosférico é sua transformação em outras moléculas. O diagrama a
seguir mostra a conversão do gás carbônico em metanol.
Indique a etapa lenta do processo. Justifique sua resposta.
www.cursosimbios.com.br
5
GABARITO:
RASCUNHO
1) Gab: D
2) Gab: D
3) Gab: E
4) Gab: E
5) Gab: E
6) Gab: D
7) Gab: A
8) Gab: 17
9) Gab:
a)
HAtivação = +50 kJ/mol
HReação = +20 kJ/mol
b)
10) Gab: D
11) Gab: A
12) Gab: A
13) Gab: C
14) Gab: E
15) Gab:
a)
A análise do gráfico nos indica que:
tempo / s
[i P ]
10 3 molL1
[PA ]
0
100 200
0,0
1,8
2,0
0,0 6,8 7,7
10 3 molL1
b)
As formações de i – P e PA– ocorrem na proporção de 1 : 1 a
–
partir de P. Logo, a quantidade total desses produtos i – P e PA , que
-3
-3
-3
-1
é igual a 2,0 10 + 7,7 10 = 9,7 10 molL , corresponderá à
concentração inicial de P.
tempo / s
[i P]
10 3 molL1
[PA ]
0
0,0
100 200
1,8
2,0
0,0 6,8 7,7
10 3 molL1
[P]
9,7 1,1 0,0
3
10 molL1
c)
Pelo gráfico, observa-se que se forma uma maior concentração
de PA– do que de i – P num mesmo intervalo de tempo, sendo,
portanto, mais rápida a reação de hidrólise (formação de PA–).
16) Gab: B
17) Gab: B
18) Gab: A
19) Gab: E
20) Gab:
A etapa lenta é a etapa que vai de II a III, por apresentar a maior
energia de ativação.
www.cursosimbios.com.br
6