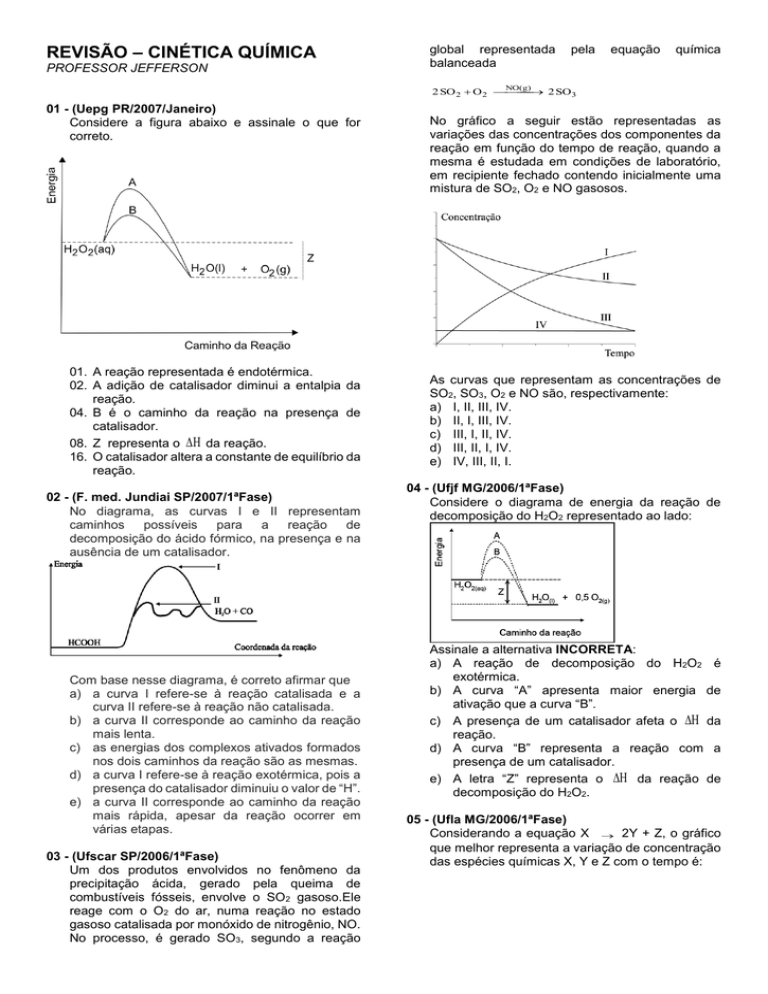
REVISÃO – CINÉTICA QUÍMICA
PROFESSOR JEFFERSON
global representada
balanceada
pela
equação
química
NO(g )
2 SO 2 O 2
2 SO3
01 - (Uepg PR/2007/Janeiro)
Considere a figura abaixo e assinale o que for
correto.
01. A reação representada é endotérmica.
02. A adição de catalisador diminui a entalpia da
reação.
04. B é o caminho da reação na presença de
catalisador.
08. Z representa o da reação.
16. O catalisador altera a constante de equilíbrio da
reação.
02 - (F. med. Jundiai SP/2007/1ªFase)
No diagrama, as curvas I e II representam
caminhos possíveis para a reação de
decomposição do ácido fórmico, na presença e na
ausência de um catalisador.
Com base nesse diagrama, é correto afirmar que
a) a curva I refere-se à reação catalisada e a
curva II refere-se à reação não catalisada.
b) a curva II corresponde ao caminho da reação
mais lenta.
c) as energias dos complexos ativados formados
nos dois caminhos da reação são as mesmas.
d) a curva I refere-se à reação exotérmica, pois a
presença do catalisador diminuiu o valor de “H”.
e) a curva II corresponde ao caminho da reação
mais rápida, apesar da reação ocorrer em
várias etapas.
03 - (Ufscar SP/2006/1ªFase)
Um dos produtos envolvidos no fenômeno da
precipitação ácida, gerado pela queima de
combustíveis fósseis, envolve o SO2 gasoso.Ele
reage com o O2 do ar, numa reação no estado
gasoso catalisada por monóxido de nitrogênio, NO.
No processo, é gerado SO3, segundo a reação
No gráfico a seguir estão representadas as
variações das concentrações dos componentes da
reação em função do tempo de reação, quando a
mesma é estudada em condições de laboratório,
em recipiente fechado contendo inicialmente uma
mistura de SO2, O2 e NO gasosos.
As curvas que representam as concentrações de
SO2, SO3, O2 e NO são, respectivamente:
a) I, II, III, IV.
b) II, I, III, IV.
c) III, I, II, IV.
d) III, II, I, IV.
e) IV, III, II, I.
04 - (Ufjf MG/2006/1ªFase)
Considere o diagrama de energia da reação de
decomposição do H2O2 representado ao lado:
Assinale a alternativa INCORRETA:
a) A reação de decomposição do H2O2 é
exotérmica.
b) A curva “A” apresenta maior energia de
ativação que a curva “B”.
c) A presença de um catalisador afeta o H da
reação.
d) A curva “B” representa a reação com a
presença de um catalisador.
e) A letra “Z” representa o H da reação de
decomposição do H2O2.
05 - (Ufla MG/2006/1ªFase)
Considerando a equação X 2Y + Z, o gráfico
que melhor representa a variação de concentração
das espécies químicas X, Y e Z com o tempo é:
a)
c)
b)
d)
e)
06 - (Unesp SP/2006/Biológicas)
A oxidação da glicose no nosso organismo, levando
a dióxido de carbono e água, é um processo
bioquímico. O perfil energético dessa reação pode
ser representado esquematicamente pelo gráfico:
a) O que se pode afirmar sobre a entalpia desta
reação? Qual o significado de .AB?
b) Compare a oxidação da glicose em nosso
organismo, até CO2 e H2O, com a sua
combustão completa, feita num frasco de
laboratório. Pode-se afirmar que este último
processo envolve maior quantidade de
energia? Justifique sua resposta.
Assinale a seqüência correta.
a) F, F, V
b) F, F, F
c) V, V, F
d) V, F, V
e) F, V, F
08 - (Ufu MG/2006/1ªFase)
O papel de um catalisador em um equilíbrio químico
é
a) aumentar a energia da reação, gerando uma
quantidade maior de produto em um menor
tempo de reação.
b) alterar o valor da constante de equilíbrio,
favorecendo a reação química.
c) inverter os produtos pelos reagentes,
modificando a velocidade da reação química.
d) diminuir o intervalo de tempo necessário para o
estabelecimento do equilíbrio da reação
química.
09 - (Ufmg MG/2006/2ªFase)
Nitrato de chumbo (II), Pb(NO3)2, e iodeto de
potássio, KI, são incolores e solúveis em água,
mas, ao reagirem entre si, levam à formação de
iodeto de chumbo (II), PbI2, amarelo e insolúvel em
água, como um dos produtos da reação.
1. ESCREVA a equação completa e balanceada
que representa essa reação entre soluções
aquosas de nitrato de chumbo (II) e de iodeto
de potássio.
2. Uma forma interessante de se fazer essa
reação é acrescentar, simultaneamente,
usando espátulas, pitadas dos dois reagentes
sólidos a um recipiente cilíndrico raso por
exemplo, uma placa de Petri , em que foi
colocada água em quantidade apenas
suficiente para cobrir o fundo do recipiente,
formando uma película muito fina de líquido. Os
reagentes são colocados separados e em
lugares diametralmente opostos.
Inicialmente, ocorre a dissolução dos dois
sólidos incolores. Depois de algum tempo,
nota-se a formação de uma fina linha amarela
de precipitado, mais próxima do lugar original,
onde foi colocado o nitrato de chumbo (II)
sólido.
07 - (Ufmt MT/2006/1ªFase)
O octano é um dos componentes da gasolina.
Sobre a reação abaixo de combustão de vapores
de octano, marque V para as afirmativas
verdadeiras e F para as falsas.
2 C8H18 (g) 25 O2 (g) 16 CO2 (g) 18 H2O(g)
( ) Essa reação ocorre em uma só etapa, pois
produz poucos rearranjos de ligações
químicas.
( ) Para que a reação ocorra em uma só etapa, é
necessário que cada duas moléculas de octano
colidam, simultaneamente, com 25 moléculas
de oxigênio.
( ) A rapidez dessa reação deve-se ao fato de
ocorrer em uma só etapa.
As considerações da teoria cinético-molecular
podem ser aplicadas a um líquido e às espécies
nele dissolvidas.
Assim sendo, INDIQUE se a energia cinética
média dos íons chumbo (II) é menor, igual ou
maior que a dos íons iodeto. Considere que a
temperatura de todo o sistema água e sais
é constante.
Em termos da teoria cinético-molecular,
JUSTIFIQUE sua resposta.
3. Em termos da teoria cinético-molecular,
EXPLIQUE por que a linha do precipitado se
forma mais próximo ao lugar onde, no início do
experimento, foi colocado o nitrato de chumbo
(II).
10 - (Unifap AP/2006/2ªFase)
A velocidade de uma reação é dependente de
vários fatores. Considere a reação do Ferro com
ácidos, conforme representado pela equação de
reação abaixo:
Fe(s) 2H (aq) Fe2 (aq) H 2 (g)
Baseado no exposto acima, faça o que se pede:
a) Compare a velocidade da reação quando se
utiliza 1,0 g de prego de ferro e quando se
utiliza 1,0 g de palha de aço. Justifique sua
resposta.
b) Escreva a equação química balanceada que
representa a reação do Fe(s) com o HCl(aq).
A decomposição do peróxido de hidrogênio (H2O2)
em solução aquosa (água oxigenada) é catalisada
pela adição de uma gota de bromo (Br2) à solução.
Br2
2H2O2(aq)
2 H2O(l) + O2(g)
O mecanismo proposto para o processo ocorre em
duas etapas:
Br2(aq) + H2O2(aq) 2 Br– (aq) + 2H+(aq) + O2(g)
2Br–(aq) + 2H+(aq) + H2O2(aq) Br2(aq) +
2H2O(l)
43.
O caminho da reação na presença e na ausência
de catalisador é representado no gráfico a seguir:
11 - (Unesp SP/2006/Biológicas)
Na química atmosférica, os óxidos de nitrogênio
desempenham um papel importante, mantendo e
poluindo a atmosfera, e são conhecidos
coletivamente como NOx. O óxido de nitrogênio,
NO, contribui, como os clorofluorcarbonos, na
destruição da camada de ozônio, segundo as
reações:
NO O3 NO2 O2 (I)
NO2 O NO O2 (II)
O resultado final dessas reações é a destruição de
uma molécula de ozônio, O3 O 2O2 .
Considerando as reações (I) e (II),
a) determine o número de oxidação do nitrogênio
nos compostos presentes nas equações;
b) indique, com justificativa, por que o NO é tão
prejudicial na destruição da camada de ozônio.
12 - (Unesp SP/2006/Exatas)
As velocidades das reações químicas podem ser
aumentadas pelo aumento da temperatura; a altas
temperaturas, mais moléculas possuem energia
maior que a energia de ativação da reação. A
velocidade de uma reação também pode ser
acelerada pelo uso de um catalisador.
a) O que são catalisadores homogêneos e
catalisadores heterogêneos?
b) Explique a ação de um catalisador numa
reação química.
13 - (Unimes SP/2006)
Observando a reação abaixo:
Pt
2SO2(g) + O2(g)
2 SO3(g)
Pode-se afirmar que o papel desempenhado pela
platina é o de promover:
a) catálise homogênea.
b) catálise heterogênea.
c) heterólise.
d) homólise.
e) eletrólise.
14 - (Puc SP/2006)
Sobre a decomposição do peróxido de hidrogênio
em solução aquosa é INCORRETO afirmar que
a) independentemente da ação do catalisador, a
reação é exotérmica.
b) apesar de o bromo (Br2) reagir com o H2O na
primeira etapa do mecanismo proposto, ele é
totalmente regenerado durante a segunda
etapa, não sendo consumido durante o
processo.
c) a presença do bromo altera a constante de
equilíbrio do processo, favorecendo a formação
do oxigênio e da água.
d) na primeira etapa do mecanismo proposto, o
Br2(l) é reduzido a Br–(aq) e na segunda etapa,
o ânion Br– (aq) é oxidado a Br2(l).
e) a ação do catalisador possibilita um novo
mecanismo de reação, que apresenta menor
energia de ativação, aumentando a velocidade
do processo.
15 - (Umg MG/2006)
Analise este gráfico, em que está representada a
variação da concentração de um reagente em
função do tempo em uma reação química:
Considerando-se as informações desse gráfico, é
CORRETO afirmar que, no intervalo entre 1 e 5
minutos, a velocidade média de consumo desse
reagente é de:
a) 0,200 (mol / L) / min .
b) 0,167 (mol / L) / min .
c) 0,225 (mol / L) / min .
d) 0,180 (mol / L) / min .
Experimento pH
1
2
5
4
[sacarose]
Velocidadede
1
(mol L ) reação (mol L1 s 1 )
0,1
v1
0,1
v2
Sabe-se que a lei de velocidade para a reação é
expressa por:
v k [sacarose]1 [H ]1
16 - (Mackenzie SP/2006)
Para a decomposição do dióxido de nitrogênio,
produzindo monóxido de nitrogênio e gás oxigênio
a uma temperatura t, a lei de velocidade é v =
k[NO2]2.
Se a concentração em mol do NO2 for triplicada,
sem variação da temperatura, a velocidade dessa
reação
a) fica multiplicada por dois.
b) fica multiplicada por três.
c) fica multiplicada por seis.
d) fica multiplicada por nove.
e) permanece a mesma.
17 - (Fepcs DF/2006)
Analisando a influência da concentração dos
regentes na velocidade da reação entre o monóxido
de nitrogênio e oxigênio, observamos que quando
a concentração do NO é dobrada, a velocidade da
reação aumenta por um fator 4. Se as
concentrações de NO e O2 são dobradas, a
velocidade aumenta por um fator 8. A expressão da
velocidade dessa reação é:
a) v = k [NO]2[O2];
b) v = k [NO]2[O2]2;
c) v = k [NO] [O2];
d) v = k [NO]4[O2]2;
e) v = k [NO] [O2]2.
Onde k é a constante de velocidade e depende
somente da temperatura. Com base nesses dados,
o valor correto da razão v1/v2 é
a) 0,02.
b) 0,1.
c) 1.
d) 10.
e) 0,01.
20 - (Udesc SC/2006)
Considere a seguinte reação:
2 NO(q) Br2(q) 2 NOBr(q)
Com base nos dados experimentais obtidos em
uma temperatura de 273oC, calcule a constante de
velocidade da reação, e assinale a alternativa
correta.
Experiência
18 - (Unimar SP/2006)
Para a reação:
A B C Produtos
Os seguintes dados foram coletados:
A lei de velocidade para a reação é:
a) v = K[A][B][C]
b) v = K[A][B][C]2
c) v = [A][C]2
d) v = K[A]2[C]4
e) v = K[A]2[B][C]4
19 - (Furg RS/2006)
A inversão da sacarose à temperatura de 25 ºC
ocorre com uma velocidade (rapidez) de reação
igual a “v” e depende do pH. Os dados obtidos nos
instantes iniciais da reação, em dois experimentos,
são mostrados na tabela abaixo:
a)
b)
c)
d)
e)
Velocidade
Concentração inicial
Inicial
(moles / L)
(moles / L.s)
NO
Br2
1
0,2
0,2
2
0,2
0,4
48
3
0,2
0,6
72
4
0,4
0,2
96
5
0,6
0,2
216
24
6,0 103 L2 / mol2.s
3,0 103 L2 / mol2.s
6,0 102 L / mol.s
0,8 103 L2 / mol2.s
3,0 103 L / mol.s
21 - (Ufsc SC/2006)
A sacarose sofre reação de hidrólise em meio
aquoso produzindo glicose e frutose. O gráfico
abaixo representa a variação da concentração de
sacarose em função do tempo em dois valores
diferentes de pH, à temperatura de 298 K. A
equação simplificada para a reação pode ser
escrita como:
H2C
O
HC
H2C
De acordo com as informações do enunciado e do
gráfico acima, assinale a(s) proposição(ões)
CORRETA(S).
01. A reação é catalisada por ácidos.
02. Frutose e glicose são isômeros.
04. A velocidade média da reação na primeira hora
em pH = 0,3 é 0,36 0,02 mol dm–3 h–1.
08. Em cada pH, o tempo necessário para que uma
dada concentração de sacarose caia para a
metade é constante durante toda a reação.
16. A equação de velocidade da reação é v =
k[C12H22O11] [H2O].
22 - (Unicap PE/2006)
Considere a seguinte reação química:
N 2(g) O 2(g) NO2(g) (não balanceada)
em que a equação da velocidade é expressa por:
v kN 2 O 2 2
00. Ao duplicarmos a concentração de O2 e
reduzirmos a metade da concentração de N2, a
velocidade da reação torna-se duas vezes
maior.
01. A reação fica duas vezes mais rápida se
duplicarmos a concentração de N2.
02. A velocidade fica inalterada se variarmos
igualmente as concentrações de N2 e O2.
03. Mantidos constantes o volume, a temperatura
e a concentração de N2 e diminuindo pela
metade a concentração de O2, a velocidade
aumenta quatro vezes.
04. Sob volume constante, uma diminuição de
temperatura provoca uma diminuição na
velocidade da reação.
O
CO
CO
H2C
R
,
R + 3R-OH
Álcool
primário
O CO R
Óleo vegetal
HC
H2C
OH
,
OH + 3R-O-CO-R
Biodiesel
OH
Glicerol
Na reação de obtenção do biodiesel,
a) a velocidade média de formação do biodiesel é
o triplo da velocidade de consumo do álcool
primário.
b) a velocidade média de consumo do óleo
vegetal é igual à velocidade de formação do
biodiesel.
c) a velocidade média de formação do glicerol é
igual à velocidade de formação do biodiesel.
d) a velocidade média de consumo do álcool
primário é o triplo da velocidade de consumo do
óleo vegetal.
24 - (Fatec SP/2006)
Pode-se detectar a presença de iodetos em águasmães de salinas, por meio da reação representada
pela equação
H2O2(aq) + 2H+(aq) + 2I–(aq)
I2(aq)
2H2O2(l)
+
Os seguintes gráficos, mostrando a velocidade da
reação em função da concentração dos reagentes,
foram construídos com os dados coletados em
vários experimentos:
variando a concentração de H2O2 e mantendo
constantes as de H+ e I–;
variando a concentração de H+ e mantendo
constantes as de H2O2 e I–;
variando a concentração de I– e mantendo
constantes as de H2O2 e H+.
v
v
[H+]
[H2O2]
v
[I-]
23 - (Ufrn RN/2006)
O biodiesel tem se mostrado uma fonte de energia
alternativa em substituição ao diesel e a outros
derivados do petróleo. Suas principais vantagens
são reduzir os níveis de poluição ambiental e ser
uma fonte de energia renovável. O biodiesel pode
ser obtido a partir da reação de óleos vegetais
brutos com alcoóis primários em meio básico, como
mostrado abaixo:
Com base na análise dos gráficos, afirma-se que a
velocidade da reação
I depende apenas da concentração de H+.
II é diretamente proporcional à concentração de
H2O2.
III independe da concentração de H+.
IV é inversamente proporcional à concentração de
I–.
É correto o que se afirma apenas em:
a) I
b) III
c) IV
d) II e III
e) II, III e IV
25 - (IME RJ/2006)
Para a reação A + B C foram realizados três
experimentos, conforme a tabela abaixo:
Determine:
a) a lei da velocidade da reação acima;
b) a constante de velocidade;
c) a velocidade de formação de C quando as
concentrações de A e B forem ambas 0,50 M.
GABARITO:
01 - Gab: 12
02 - Gab: E
03 - Gab: C
04 - Gab: C
05 - Gab: B
06 - Gab:
a) Observando o gráfico, concluímos que a
entalpia do sistema diminui, isto é, a entalpia
dos reagentes é maior que a entalpia dos
produtos. Isto
evidencia uma reação exotérmica( ΔΗ 0 ).
Ainda no gráfico, AB indica a energia de
ativação (energia mínima necessária para a
reação ocorrer) da oxidação da glicose.
b) Entalpia é uma função de estado, isto é,
depende apenas do estado inicial (reagentes)
e do estado final (produtos). Tanto na oxidação
da glicose em nosso organismo, como na sua
combustão completa, temos os mesmos
reagentes e produtos. Logo a quantidade de
energia envolvida em ambos os processos é a
mesma.
07 - Gab: E
08 - Gab: D
09 - Gab:
1. Pb( NO3 ) 2 2KI PbI2 2KNO3
2. A energia cinética dos íons iodeto é maior que
a energia cinética dos íons chumbo–II.
Podemos comprovar tal fato devido ao maior
deslocamento dos íons iodetos em relação aos
íons chumbo.
3. Porque os íons chumbo deslocam menos que
os íons iodeto.
10 - Gab:
a) A velocidade de uma reação química, aumenta
à medida que se aumenta a superfície de
contato. Logo, a velocidade de reação da pilha
de aço com HCl é maior.
b) Fe(s) 2HC(aq) FeCl2 (aq) H2 (g)
11 - Gab:
a) NO = +2 e NO2 = +4
b) O NO é consumido na reação I e formado na II.
Desse modo, uma única molécula de NO
poderá reagir com diversas moléculas deO3.
12 - Gab:
a) O catalisador homogêneo constitui, juntamente
com o(s) reagente(s), um sistema monofásico
(homogêneo). O catalisador heterogêneo
constitui uma fase diferente daquela(s) dos
reagentes, de modo a constituir um sistema
polifásico (heterogêneo).
b) O catalisador diminui a energia de ativação da
reação. Desse modo, existirão mais moléculas
com energia maior que a energia de ativação,
então haverá mais choques efetivos e,
conseqüentemente, maior velocidade da
reação química.
13 - Gab: B
14 - Gab: C
15 - Gab: A
16 - Gab: D
17 - Gab: A
18 - Gab: C
19 - Gab: B
20 - Gab: B
21 - Gab: 11
22 - Gab: VVFFV
23 - Gab: D
24 - Gab: D
25 - Gab:
a) V = k [A] . [B]
b) 2,0 . 10–1 mol L–1.min–1
c) 5,0 . 10–2 mol L–1.min–1