Aluno(a) :______________________________________________________________
PROF.: WESLEY
DE PAULA
QUÍMICA
01 - (UDESC SC/2011) Considere as seguintes etapas de uma reação:
Etapa 1:NO2(g) + NO2(g) → NO3(g) + NO(g) (lenta)
Etapa 2:NO3(g) + CO(g) → NO2(g) + CO2(g) (rápida)
CINÉTICA
QUÍMICA
LISTA N° 04
08. O valor da constante de velocidade k é 2,7 10–4 l mol–1 s–1.
16.
A velocidade de uma reação e sua constante de velocidade
dependem da concentração inicial dos reagentes.
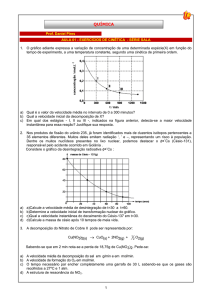
05 - (UFC CE/2010) A tabela abaixo apresenta os resultados obtidos para
Assinale a alternativa incorreta.
o estudo cinético de uma reação química elementar genérica na forma aA
a) A expressão da velocidade de reação pode ser escrita como v =
+ bB + cC
D + E.
k[NO2][NO2].
b) A expressão da velocidade de reação pode ser escrita como v =
Velocidade
Experiment o [A] [B] [C]
k[NO2]2.
mol.L-1s-1
c) A velocidade da reação depende da primeira etapa.
d) A velocidade da reação é sempre governada pela última etapa.
1
0,10 0,10 0,10 8,0.10 4
e) A equação global da reação é NO2(g) + CO(g) → NO(g) + CO2(g).
3
2
0,20 0,10 0,10
1,6.10
02 - (UFG GO/2011) A amônia é matéria-prima para a fabricação de
3
0,10 0,20 0,10 1,6.103
fertilizantes como a ureia (CON2H4), o sulfato de amônio [(NH4)2SO4)] e o
4
0,10 0,10 0,20 3,2.103
fosfato de amônio [(NH4)3PO4]. A reação de formação da amônia se
processa em duas etapas, conforme equações químicas fornecidas A partir destes resultados, determine:
abaixo.
a) a lei de velocidade da reação.
b) o valor da velocidade da reação quando [A] = [B] = [C] = 0,20 mol L-1
N2 (g) + 2 H2 (g) N2H4 (g) (1) lenta
N2H4 (g) + H2 (g) 2 NH3 (g) (2) rápida
06 - (UDESC SC/2010) As espécies químicas A e B reagem a uma certa
temperatura de acordo com a reação 2 A (g) + 2 B(g) C(g) . Verificou-se
Dessa forma, a velocidade da equação global N2 (g) + 3 H2 (g) 2 NH3 que a velocidade desta reação quadruplica quando a concentração de A
(g) é dada pela seguinte expressão:
duplica, independente da concentração de B.
Assinale a alternativa que corresponde à expressão da velocidade e ao
valor da ordem da reação, respectivamente.
a) v = k [N2] [H2]2
a) v = k [A]2 e 2
b) v = k [NH3]2
3
b) v = k [A]2 e 4
c) v = k [N2] [H2]
c) v = k [A]2 [B]2 e 2
d) v = k [NH3]2/[N2] [H2]3
2
d) v = k [A]2 [B]2 e 4
e) v = k [N2H4]/[N2] [H2]
e) v = k [A]2 [B]2 e 1
03 - (MACK SP/2010) Os dados empíricos para a velocidade de reação,
v, indicados no quadro a seguir, foram obtidos a partir dos resultados em 07 - (UFG GO/2010) O gráfico a seguir representa o estudo cinético de
diferentes concentrações de reagentes iniciais para a combustão do gás uma reação R → P.
A, em temperatura constante.
Experiment o [A](mol.L1 ) [O 2 ](mol.L1 ) v(mol.L1.min 1 )
1
1,0
4,0
4,0 10 4
2
2,0
4,0
32 10 4
3
1,0
2,0
2,0 10 4
A equação de velocidade para essa reação pode ser escrita como v = k
[A]x·[O2]y, em que x e y são, respectivamente, as ordens de reação em
relação aos componentes A e O2.
Assim, de acordo com os dados empíricos obtidos, os valores de x e y
são, respectivamente,
a) 1 e 3.
b) 2 e 3.
c) 3 e 1.
d) 3 e 2.
e) 2 e 1.
Sabendo-se que o consumo do reagente se dá conforme a equação [R] =
1/t, e a formação do produto pela equação [P] = 1 – 1/t, com t, o tempo,
em segundos,
a) determine o instante, em segundos, em que a concentração dos
reagentes é igual à dos produtos;
b) represente o gráfico do estudo cinético após a adição de um
catalisador.
04 - (UEM PR/2010) Considerando a reação e os dados da tabela abaixo,
assinale o que for correto.
NO2(g) + O2(g) não
08 - (UFT TO/2010) A seguinte reação N2O5(g)
NH4+(aq) + NO2–(aq) N2(g) + 2H2O(l)
balanceada está representada no gráfico abaixo, onde observa-se a
concentração mol/L em função do tempo de reação.
Velocidade ,
Experiment o
[NH4 ]inicial [NO2 ]inicial
(mol/ L)
0,20
v (mol/L.s)
1
(mol/ L)
0,01
2
0,02
0,20
10,8 107
3
0,20
0,02
10,8 107
4
0,20
0,04
21,6 10 7
5,4 107
01. A velocidade desta reação pode ser estudada, medindo-se a
concentração de NH4+(aq) ou a de NO2–(aq) em função do tempo ou o
volume de N2(g) coletado, também, em função do tempo.
02. As velocidades de consumo (ou desaparecimento) de NH4+(aq) e de Considerando o gráfico, assim como a equação citada, é CORRETO
NO2– (aq) são iguais.
afirmar:
04. A lei de velocidade deve ser escrita como v = k[NH4+][NO2–].
a) C é o produto principal, portanto o de menor concentração.
b) O reagente C é responsável pela formação dos produtos A e B.
c) O gráfico demonstra que durante a reação o aumento dos reagentes A
e B dependem diretamente do produto C.
d) O número de mol formado no produto é menor que número de mol do
reagente.
e) A falta do balanceamento estequiométrico leva à não determinação de
reagentes e produtos.
c) ATP e CTP agem independentemente da concentração do substrato.
d) ATP é um ativador e CTP um inibidor enzimático.
e) ATP e CTP competem pelo substrato.
12 - (UNESP SP/2008) Os catalisadores desempenham importante papel
em vários processos químicos. Uma reação genérica entre os reagentes A
e B pode ocorrer na ausência ou na presença de um catalisador (cat).
AB
C D não catalisada
cat
09 - (UEPG PR/2009) Numa das etapas de produção do ácido sulfúrico A B C D catalisada
ocorre a reação equacionada 2 SO2 (g) + O2 (g) 2 SO3 (g). A respeito Indique a alternativa que melhor representa as reações catalisada e não
desta reação, que é normalmente realizada mediante o emprego de catalisada.
platina metálica sólida como catalisador, como mostra o diagrama abaixo,
assinale o que for correto.
a)
c)
01. O ácido sulfúrico é obtido a partir da reação:
SO3 (gas) + H2O (liq) H2SO4 (aq).
02. A catálise mediante o emprego de platina metálica sólida como
catalisador é denominada catálise heterogênea, e o catalisador tem como
função diminuir a energia de ativação da reação.
04. As letras x e y correspondem, respectivamente, às energias de
ativação da reação catalisada e da reação não catalisada.
08. O trecho marcado com a letra z corresponde à entalpia da reação
(H), e ela não é afetada pela presença do catalisador.
16. A curva A corresponde à reação na ausência do catalisador, enquanto
a curva B corresponde à reação na presença do catalisador.
e)
10 - (UFG GO/2009) Uma das formas de representar mecanismos de
reações químicas é apresentado no gráfico a seguir, que representa as
várias etapas de uma reação.
b)
d)
13 - (UFRJ/2006) A figura a seguir apresenta a variação da entalpia ao
longo do caminho de uma reação.
De acordo com esse gráfico,
a) o uso de um catalisador aumentará a energia liberada pela reação.
b) o uso de um catalisador diminuirá a energia liberada pela reação.
c) o uso do catalisador, para aumentar a velocidade da reação, é mais
efetivo na segunda etapa.
d) a primeira etapa é a que determina a velocidade da reação.
e) a terceira etapa é a que determina a velocidade da reação.
a) Determine o valor da entalpia desta reação, classificando-a como
endotérmica ou exotérmica.
b) Explique qual o efeito de um catalisador sobre a energia de ativação e
sobre a entalpia da reação.
GABARITO:
2
11 - (UFG GO/2009)
O gráfico a seguir representa a influência do 1) Gab: D 2) Gab: A 3) Gab: C 4) Gab: 15 5) Gab: a)v= 8[A][B][C] b)
–2
–1 –1
1,2810 mol L s . 6) Gab: A 7) Gab:a)t = 2s b) Com a adição do
trifosfato de adenosina (ATP) e da citidina trifosfato (CTP) sobre a enzima
catalisador, o instante em que as concentrações dos reagentes e produtos
aspartato transcarbamilase.
se igualam é menor do que 2s, ou seja menor do que t2.
Considerando as informações do gráfico, conclui-se que
a) ATP é um inibidor e CTP um ativador enzimático.
b) ATP e CTP agem de modo sinérgico.
8) Gab: B 09) Gab: 27 10) Gab: C 11) Gab: C 12) Gab: D 13) Gab: a)
A entalpia de reação é igual a (100-300)= -200 kJ/mol de produto. A
reação é exotérmica. b)Um catalisador diminui a energia de ativação, mas
não altera o valor da entalpia de reação.