AULA PRÁTICA Nº2
TÉCNICAS DE TRANSFERÊNCIA E REPICAGEM
INTRODUÇÃO
Os ingredientes necessários para o crescimento de microrganismos podem ser
supridos por um sistema vivo, como um hospedeiro animal ou vegetal, uma cultura de
células, ou por uma mistura de todos os nutrientes requeridos em um sistema artificial,
denominado meio de cultura. Os meios de cultura contêm os nutrientes para o cultivo
dos diferentes microrganismos. Estes meios podem ser preparados no próprio
laboratório com pós desidratados, ou adquiridos prontos no comércio em placas de
Petri ou tubos de ensaio. Estes meios podem ser em caldo (líquido) ou ágar (sólido).
O isolamento de microrganismos consiste em separar uma espécie microbiana
de outras, a partir de uma amostra com população mista. Uma porção representativa
da amostra é transferida, com assepsia, para meio de cultura sólido (ágar) em placas
de Petri. Células microbianas contidas na amostra, suficientemente separadas, são
imobilizadas no gel de ágar contendo nutrientes e se multiplicam, formando um
agregado de células idênticas denominado colônia. Esse método assume que uma
colônia é proveniente de uma única célula microbiana. Quando uma colônia isolada é
transferida para um novo meio, as células se multiplicam livres de outros
microrganismos, constituindo uma colônia pura. Uma cultura pura deve produzir
colônias com aspecto similar, e a observação microscópica da cultura deve mostrar
células que são razoavelmente similares na aparência particularmente em relação ao
diâmetro da célula e a reação de Gram.
Os estudos microbiológicos e suas aplicações são efetuados com a população
dos microrganismos e não com uma única célula, sendo somente válidos se realizados
com culturas puras.
Objetivo: Conhecer e praticar as técnicas de transferência e repicagem de culturas.
1- Aproveitando o material que vocês prepararam na aula passada:
a) Distribua assepticamente (próximo ao bico de bunsen) cerca de 30mL de meio
BDA fundente (aproximadamente metade do volume da placa) em três placas
de Petri.
b) Tampe-as e espere solidificar.
2- Transferência de culturas para meio em placas:
Profa. Sarah P. Canova
Microbiologia Geral – Curso de Ciências Biológicas
Faculdades Metropolitanas Unidas – FMU
a) Observe as placas que foram expostas ao ar, do teste do enxágüe e as do
“dedo contaminado”, escolha três colônias distintas de aspecto cremoso.
b) Retire uma das colônias escolhidas com o auxílio de uma alça de inoculação e,
utilizando a técnica do esgotamento (figura abaixo), transfira para uma das
placas contendo meio BDA preparadas no item 1.
c) Repita o procedimento para as outras colônias escolhidas.
d)
Técnica do esgotamento em placa:
Fonte: http://www.fop.unicamp.br/microbiologia/aulas/isolamento.pdf
3- Repicagem de bactérias em tubos:
a) Escolha 5 colônias isoladas quaisquer e transfira para os tubos com meio BDA
inclinado, espalhando a cultura por toda a superfície do meio de cultura (figura
abaixo).
b) Incube em estufa a 30
Repique de bactérias em tubos inclinados com meio sólido:
Profa. Sarah P. Canova
Microbiologia Geral – Curso de Ciências Biológicas
Faculdades Metropolitanas Unidas – FMU
AULA PRÁTICA Nº3
COLORAÇÃO DE GRAM E OBSERVAÇÃO DE MICRORGANISMOS
PROCARIÓTICOS
INTRODUÇÃO
Nas técnicas de coloração células microbianas são inicialmente espalhadas
sobre a lâmina, formando um esfregaço, em seguida, são fixadas pelo calor e coradas.
As técnicas de coloração especial requerem o uso de pelo menos três reagentes
químicos, aplicados seqüencialmente sobre o esfregaço fixado. O primeiro reagente é
um corante que confere cor a todas as células; o segundo reagente é um
descolorante, que pode ou não remover completamente o primeiro corante da célula
ou de algumas de suas estruturas. As estruturas descoloridas podem adquirir a cor de
um segundo corante, corante de contraste. Assim, grupos de células ou suas
estruturas podem ser diferenciados com base no corante que é retido. Técnicas de
coloração simples (único corante) permitem a visualização de estruturas como flagelo,
cápsula, esporo e núcleo, enquanto as colorações especiais permitem também a
separação de microrganismos em grupos. A técnica de coloração especial mais
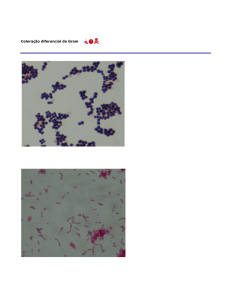
importante em bacteriologia é a coloração de Gram, que separa as bactérias em dois
grandes grupos, Gram-positivo e Gram-negativo, sendo importante no diagnóstico e
na classificação das bactérias.
A coloração de Gram envolve a aplicação de quatro soluções. Cristal violeta
(CV), primeiro corante, colore as células de roxo escuro. Lugol, ou solução de Iodo (I),
é a segunda solução, um mordente que aumenta a interação entre as células
bacterianas e o primeiro corante, formando um complexo insolúvel, Cristal violeta-Iodo
(CV-I). Álcool, a terceira solução, é um descolorante. As bactérias Gram positivas,
quando lavados com o descolorante, retêm o complexo (CV-I) e as bactérias Gram
negativas perdem o complexo (CV-I), ficando incolores. A ação do álcool como
removedor do complexo CV-I da célula depende da concentração de lipídeos e da
espessura da parede celular bacteriana. O último reagente é o corante de contraste,
Safranina ou Fucsina, de cor diferente do cristal-violeta, colore as bactérias Gramnegativas de rosa-avermelhado, mas não altera a cor roxo-escura (azulada) das
bactérias Gram-positivas.
Objetivo: Conhecer e praticar as técnicas de coloração de culturas.
Profa. Sarah P. Canova
Microbiologia Geral – Curso de Ciências Biológicas
Faculdades Metropolitanas Unidas – FMU
PARTE 1: COLORAÇÃO DE GRAM
Cada membro da equipe deve repetir os procedimentos 1 e 2 com uma das colônias
cremosas que houver em suas placas e tubos.
1- Preparo do esfregaço na lâmina:
a) Limpe uma lamina de vidro com álcool e papel fino.
b) Flambe a alça de inoculação, mantendo-a em contato com a chama até que
fique totalmente avermelhada e utilize-a para colocar uma gota de água destilada
sobre a superfície da lâmina.
c) Flambe novamente a alça no bico de Bunsen, deixe-a esfriar próxima a chama e
retire uma pequena porção de colônia do microrganismo a ser observado.
d) Transfira a cultura para a gota de água na lâmina, esfregando a alça
sobre a superfície e espalhando o conteúdo em uma camada fina e
uniforme, no centro da lâmina.
e) Passe a lâmina sobre a chama (com o inoculo para cima) duas a três vezes
seguidas.
f) Deixe secar e faça a coloração de gram (procedimento a seguir).
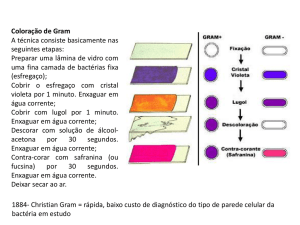
2- Coloração de Gram
Observações: tenha em mãos um relógio para contar o tempo de contato
com os corantes. Quando for lavar a lamina, abra apenas um filete de água
na torneira.
a) Coloque na lamina quantidade suficiente do corante cristal violeta para cobrir o
esfregaço e deixe em repouso por 1 minuto.
b) Lave com água e coloque a mesma quantidade de lugol, deixe em
repouso por mais 1 minuto.
c) Lave com álcool por 30 segundos e em seguida com água.
d) Cubra o esfregaço com o contra-corante safranina para Gram e deixe em
repouso por 10 segundos.
e) Lave com água, deixe a lamina secar e examine ao microscópio.
PARTE 2: OBSERVAÇÃO AO MICROSCÓPIO
1) Observe as lâminas de Bacillus subtilis, Staphylococcus aureus, Escherichea coli e
Labtobacillus bulgaricus previamente coradas pela técnica de coloração de Gram e
dispostas nos microscópios do laboratório. Anote as características na tabela abaixo e
desenhe o que observar.
Profa. Sarah P. Canova
Microbiologia Geral – Curso de Ciências Biológicas
Faculdades Metropolitanas Unidas – FMU
CULTURA
GRAM
FORMA
ARRANJO
S. aureus
E. coli
S. aureus
E. coli
2) Observe ao microscópio utilizando óleo de imersão e a objetiva com 100X de
aumento, as culturas que você corou utilizando a técnica de coloração de Gram. Anote
as características na tabela abaixo e desenhe o que observar. Compare com as
culturas conhecidas observadas no item anterior.
CULTURA
Micro-organismo 1
Micro-organismo 2
Micro-organismo 3
Micro-organismo 4
GRAM
Micro-organismo 1
Micro-organismo 3
FORMA
ARRANJO
Micro-organismo 2
Micro-organismo 4
Profa. Sarah P. Canova
Microbiologia Geral – Curso de Ciências Biológicas
Faculdades Metropolitanas Unidas – FMU
Preparo das soluções corantes
Solução de Cristal Violeta
A) cristal violeta..............................................................2,0 g
álcool etílico...............................................................20 mL
B) oxalato de amônia.......................................................0,2 g
água destilada.............................................................20 mL
Misture A e B, deixe em repouso por 24 horas e filtre antes de usar.
Solução de Iodo (lugol)
iodo..................................................................................1,0 g
iodeto de potássio............................................................2,0 g
água destilada..................................................................300 mL
Colocar o iodeto de potássio em um almofariz, adicionar o iodo e homogeneizar.
Adicionar aos poucos a água destilada homogeneizando a cada adição. Transferir
para um frasco escuro, lavando o almofariz com o restante da água a cada adição.
Solução de Safranina para Gram
safranina O.......................................................................0,25 g
etanol 95%........................................................................10 mL
água destilada..................................................................100 mL
Dissolva a safranina no álcool e adicione a solução à água.
Profa. Sarah P. Canova
Microbiologia Geral – Curso de Ciências Biológicas
Faculdades Metropolitanas Unidas – FMU