Microbiologia
Departamento de Zoologia da Universidade de Coimbra
MICROBIOLOGIA
António Verissimo
Paula Morais
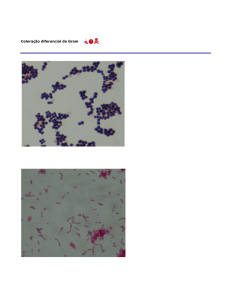
Coloração de Gram
Esta técnica permite subdividir as bactérias em dois grandes grupos:
as designadas Gram positivas, que têm a capacidade de reter o
primeiro corante usado (cristal violeta), e as Gram negativas que não
tendo essa capacidade adquirem a cor do corante utilizado depois da
lavagem com o solvente orgânico. Este facto deve-se à diferença na
espessura da camada de peptidoglicano existente nas paredes
bacterianas. Assim, uma camada espessa (como nas positivas) depois
de colapsar sob o efeito desidratante do etanol, não permite a saída do
complexo formado pelo cristal violeta e pelo iodo; contrariamente uma
camada fina de peptidoglicano (como nas negativas) mesmo colapsada
não evita a saída do corante ficando a célula incolor, por isso, a
necessidade de utilizar um corante contrastante - a safranina.
Procedimento
Utiliza-se o método de Hucker para a coloração de Gram.
As células para a coloração são retiradas de uma cultura jovem em
meio sólido, seguindo os seguintes passos:
- secagem e fixação do esfragaço com calor
- imersão do esfregaço no reagente de coloração (cristal violeta)
durante um minuto;
Microbiologia
- lavagem com água;
- imersão com mordente (iodo de Gram) durante um minuto;
- lavagem com água;
- lavagem com solvente de descoloração (etanol/acetona);
- lavagem com água;
- imersão do esfregaço em contrastante (safranina) durante um
minuto;
- lavagem com água e secagem com papel de filtro.
Observar o esfregaço
ao microscópio utilizando a objectiva de
imersão.
Reagentes para coloração de Gram
Cristal de violeta
Solução A :
Cristal de violeta
Etanol 95% (vol/vol)
2.0 g
20 mL
Solução B:
Oxalato de amónio
Água desmineralizada
0.8 g
80 mL
Misturar as soluções A e B para obter o reagente de coloração
cristal de violeta.
Deixar repousar 24 horas e filtrar por papel de filtro antes de usar.
2
Microbiologia
Mordente - Iodo de Gram
Iodo
1.0 g
Iodeto de potássio
2.0 g
Água desmineralizada até
300 mL
Triturar o iodo e o iodeto de potássio num almofariz.
Adicionar a água lentamente continuando a triturar.
Guardar numa garrafa escura.
Solvente de descoloração
Etanol / acetona (80:20) vol/vol
Corante de contraste
Safranina O (2,5% [p/vol] em etanol 95%)10 mL
Água desmineralizada
100 mL
3
Microbiologia
Coloração de flagelos:
Utiliza-se o método desenvolvido por Kodaka et. al. , que inclui os
seguintes passos:
1- preparação do esfregaço. Utilizam-se lâminas de microscópio
novas pré-lavadas. Em cada uma colocam-se duas gotas de água
estéril. Com uma ança retira-se cuidadosamente um pouco de material
de uma cultura jovem crescida em NA (18-24h a 22°C), e toca-se
primeiro numa gota e depois na outra. Colocam-se as lamelas.
2- coloração do esfregaço. Coloca-se uma gota de corante entre a
lâmina e a lamela. .
3- observação ao microscópio.
procede-se à
observação das
preparações em campo claro com objectiva de imersão (1000 vezes).
Reagentes para coloração de flagelos
Solução A:
Ácido tânico
Solução de fenol 5%
2.0g
10mL
Dissolver cuidadosamente.
Adicionar, mexendo sempre, 10mL de uma solução saturada de
sulfato de potássio e alumínio dodecahidratada. Manter a solução em
frasco de vidro escuro à temperatura ambiente.
4
Microbiologia
Solução B:
Solução saturada de cristal de violeta em etanol a 95%.
Para obter o corante final, adicionar 1 mL de B de solução
lentamente e mexendo sempre, a 10 mL de solução A. A solução final é
filtrada com papel de filtro e guardada à temperatura ambiente.
Coloração de endosporos
- Fazer um esfregaço de B. cereus e/ou B. subtilis
- Colocar num suporte com água a ferver por baixo
- Corar com verde de malaquite (5%) durante 5 minutos, mantendo
sobre a água a ferver
- Lavar com água
- Corar com safranina durante 30 s
- Lavar com água
- Observar ao microscópio (objectiva de imersão)
5