DISCIPLINA: QUÍMICA
COLÉGIO DELTA – 35 ANOS
“APAIXONADO PELA EDUCAÇÃO”
Prof.: SECÃO
APS ( X )
ANO: CURSO
DATA: 28/03/2017
Nome: ______________________________________________________
01 - (UERJ) Para diferenciar os hidrocarbonetos etano e eteno em
uma mistura gasosa, utiliza-se uma reação com bromo molecular: o
etano não reage com esse composto, enquanto o eteno reage de
acordo com a seguinte equação química:
tecnologia para aproveitar o gás metano gerado pelos bovinos, que
tem efeito estufa na atmosfera do planeta. Pesquisando o gás
metano, um grupo de estudantes da UECE realizou, em laboratório,
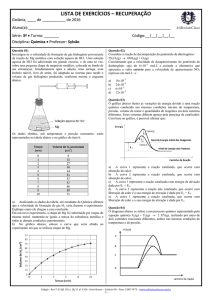
uma combustão e coletou os dados da tabela abaixo:
Tempo
(min)
0
Considere um cilindro de capacidade igual a 10 L, contendo apenas
esses hidrocarbonetos em uma mistura com massa igual a 200 g.
Ao se adicionar bromo em excesso à mistura, todo o eteno reagiu,
formando 940 g de 1,2-dibromoetano. A concentração inicial de
etano, em mol.L–1, no interior do cilindro, corresponde a:
a) 0,1
b) 0,2
c) 0,3
d) 0,4
02 - (PUC SP) O ânion bromato reage com o ânion brometo em
meio ácido gerando a substância simples bromo segundo a
equação:
BrO3– (aq) + 5 Br– (aq) + 6 H+ (aq) 3 Br2(aq) + 3 H2O(l)
A cinética dessa reação foi estudada a partir do acompanhamento
dessa reação a partir de diferentes concentrações iniciais das
espécies
BrO3– (aq), Br– (aq) e H+ (aq).
Ao analisar esse processo foram feitas as seguintes
observações:
I.
Trata-se de uma reação de oxidorredução.
II. O ânion brometo (Br–) é o agente oxidante do processo.
III. A lei cinética dessa reação é v = k[BrO3–][Br–][H+]2.
Pode-se afirmar que estão corretas
a) I e II, somente.
b) I e III, somente.
c) II e III, somente.
d) I, II e III.
03 - (UEPG PR) Considerando a seguinte reação genérica:
3Z + 2Y 4X
As etapas do mecanismo dessa reação estão abaixo
representadas:
2Z + Y W (lenta)
Y + W K (rápida)
K + Z 4X (rápida)
01. Se duplicar a concentração de Z, a velocidade
quadruplica.
02. Se duplicar a concentração de Y, a velocidade dobra.
04. A ordem da reação é 3.
08. Se triplicar simultaneamente as concentrações de Z e Y,
a velocidade da reação ficará 27 vezes maior.
16. A expressão da lei da velocidade da reação é a seguinte:
v=k[Z].[Y].
10
20
[CH 4 ]
[CO 2 ]
(mol / L) (mol / L)
0,050
0
0,030
0,020
0,020
?
Com os dados da tabela, a velocidade média da reação entre 0 e
20 minutos foi determinada com o valor
a) 1,2 10–3 mol/ L–1.min–1.
b) 0,8 10–3 mol/ L–1.min–1.
c) 1,3 10–3 mol/ L–1.min–1.
d) 1,5 10–3 mol/ L–1.min–1.
05 - (FCM PB) Conhecer os fundamentos teóricos da cinética
química é de grande importância, principalmente para as indústrias
químicas. Afinal, acelerando-se as reações, reduz-se o tempo gasto
com a produção, tornando os processos químicos mais econômicos
e os produtos finais mais competitivos no mercado. Com relação à
cinética das reações, considere o mecanismo abaixo da reação de
decomposição do peróxido de hidrogênio em presença de íons
iodeto.
Etapa 1: H2O2(aq)+ I–(aq) H2O(l) + IO–(aq)
(lenta)
Etapa 2: H2O2(aq) + IO–(aq) H2O(l) + O2(g) + I–(aq)
(rápida)
Com base no mecanismo, assinale a alternativa correta.
a) O íon IO–(aq) é o intermediário da reação.
b) O íon I–(aq) atua aumentando a energia de ativação.
c) A água é o complexo ativado da reação.
d) A lei de velocidade do processo é v = k [H2O2]2.
e) A segunda etapa é a determinante da velocidade.
06 - (UNESP SP) A indústria de doces utiliza grande quantidade
de açúcar invertido para a produção de biscoitos, bolos, bombons,
dentre outros produtos. O açúcar invertido consiste em um xarope
transparente, isento de odores, com poder edulcorante maior que o
da sacarose e é obtido a partir da reação de hidrólise ácida ou
enzimática, de acordo com a equação:
catalisador
C12 H 22O11 H 2 O
C 6 H12O 6 C 6 H12O 6
sacarose
glicose
frutose
Em uma reação de hidrólise enzimática, inicialmente, a
concentração de sacarose era de 0,12 mol L–1. Após 10 h de
reação, a concentração caiu para 0,06 mol L–1 e, após 20 h de
reação, a concentração caiu para 0,03 mol L–1. Determine a meiavida da reação e a velocidade média de consumo da sacarose, em
mol L–1 min–1, no intervalo entre 600 e 1 200 min.
07 - (UNESP SP) Em um laboratório, nas condições ambientes,
uma determinada massa de carbonato de cálcio (CaCO 3) foi
colocada para reagir com excesso de ácido nítrico diluído. Os
valores do volume de gás liberado pela reação com o transcorrer do
tempo estão apresentados na tabela.
04 - (UECE)
Manchete do jornal o Estado de São Paulo em
23.04.2014: “Gás metano produzido por vacas é usado para
abastecer veículos”. Cientistas argentinos desenvolveram
-1-
Colégio Delta
www.colegiodelta.com.br
e)
Escreva a equação balanceada da reação e calcule a velocidade
média da reação, em mol min–1, no intervalo entre 1 minuto e 3
minutos.
Dado:
• Volume molar do CO2 nas condições ambientes = 25,0
L mol–1
AM
1ª ordem em relação a “A” e de 1ª ordem em relação a
“B”
11 - (UNISC RS)
Uma reação química normalmente envolve
aspectos energéticos e cinéticos. Interprete o gráfico a seguir, que
ilustra uma reação hipotética desenvolvida na presença e na
ausência de catalisador e indique a alternativa verdadeira.
08 - (UFJF MG) Alguns óxidos gasosos de nitrogênio e carbono
são poluentes atmosféricos. A reação de NO2 com monóxido de
carbono gera NO e dióxido de carbono. Em um estudo cinético
dessa reação, foram obtidos os seguintes dados para a velocidade
da reação química em função das concentrações iniciais dos
reagentes:
a)
b)
a)
b)
c)
d)
Escreva a equação química balanceada que representa
essa reação.
Qual é a lei de velocidade para essa reação química?
Qual é o valor da constante de velocidade dessa reação
a 350 K? Apresente os cálculos.
A temperatura da reação na última linha da tabela acima
é maior, menor ou igual às outras três temperaturas de
reação? Justifique sua resposta.
c)
d)
e)
A reação é exotérmica com energia de ativação sem o
catalisador de 30 Kcal.
A reação é endotérmica com energia do complexo
ativado sem catalisador de 43 Kcal.
A reação apresenta uma energia de ativação de 30 Kcal
sem catalisador e 17 Kcal com o catalisador.
A reação é endotérmica e tem um H 30 Kcal .
A energia de ativação da reação diminui em 17 Kcal com
a utilização do catalisador.
12 - (UNIRG TO) Assinale a única alternativa correta com relação
aos diagramas de energia (I) e (II) para a reação A B .
09 - (UFRR)
Considere a reação de combustão completa do
metano (não balanceada):
CH4(g) + O2(g) CO2(g) + H2O(l)
Se admitirmos que a velocidade média constante de consumo de
metano é de 0,25 mol/min, a massa de gás carbônico, em gramas,
produzida em 1 hora será de:
a) 111
b) 1320
c) 540
d) 132
e) 660
10 - (UEPA)
De um modo geral, a ordem de uma reação é
importante para prever a dependência de sua velocidade em
relação aos seus reagentes, o que pode influenciar ou até mesmo
inviabilizar a obtenção de um determinado composto. Sendo assim,
os dados da tabela abaixo mostram uma situação hipotética da
obtenção do composto “C”, a partir dos reagentes “A” e “B”.
a)
b)
c)
d)
Ambos diagramas representam reações endotérmicas.
A Entalpia dos reagentes é menor no diagrama II.
A reação catalisada está apresentada no diagrama II.
As duas curvas apresentam o mesmo valor para a
Energia do complexo ativado.
13 - (UEPG PR) Observando o gráfico abaixo, que representa o
desenvolvimento de uma reação, assinale o que for correto.
A partir dos dados da tabela acima, é correto afirmar que a reação:
A + B C, é de:
a) 2ª ordem em relação a “A” e de ordem zero em relação a
“B”
b) 1ª ordem em relação a “A” e de ordem zero em relação a
“B”
c) 2ª ordem em relação a “B” e de ordem zero em relação a
“A”
d) 1ª ordem em relação a “B” e de ordem zero em relação a
“A”
-2-
01. A reação X + Y Z é uma reação endotérmica.
02. 32 kcal é a energia do complexo ativado.
04. Na formação de Z, a energia dos reagentes é menor do
que a do produto.
08. 42 kcal é a energia de ativação para X + Y Z.
16. A reação Z X + Y tem H = –12 kcal.
Colégio Delta
www.colegiodelta.com.br
14 - (UEPG PR)
O diagrama de entalpia abaixo fornece
informações sobre uma reação química reversível. Considerando
que o sistema está em equilíbrio, assinale o que for correto.
AM
reações. Assim, o efeito que causam para acelerar a velocidade
das reações é
a)
b)
c)
d)
e)
aumentar a energia de ativação.
não formar o complexo ativado.
gerar instabilidade dos produtos.
reduzir a energia de ativação.
alterar os produtos obtidos na reação.
18 - (FUVEST SP) Sabe-se que os metais ferro (Feº), magnésio
(Mgº) e estanho (Snº) reagem com soluções de ácidos minerais,
liberando gás hidrogênio e formando íons divalentes em solução.
Foram feitos três experimentos em que três amostras metálicas de
mesma massa reagiram, separada e completamente, com uma
solução aquosa de ácido clorídrico (HC(aq)) de concentração 0,1
mol/L. Os resultados obtidos foram:
01. Esta é uma reação exotérmica, pois a entalpia dos
produtos é menor que a dos reagentes.
02. A curva de maior energia de ativação (Ea) se refere à
reação catalisada.
04. Um aumento na temperatura do sistema não favoreceria
essa reação porque o equilíbrio seria deslocado no
sentido dos reagentes.
08. A adição dos reagentes A ou B provocaria um
deslocamento do equilíbrio para a direita e a formação de
maior quantidade de C.
16. Se houver uma diminuição na pressão do sistema, o
equilíbrio será deslocado no sentido dos produtos.
15 - (UFRGS RS) Para a obtenção de um determinado produto,
realiza-se uma reação em 2 etapas. O caminho dessa reação é
representado no diagrama abaixo.
Colocando-se os valores de V1, V2 e V3 em ordem
decrescente, obtém-se
a) V2 > V3 > V1
b) V3 > V1 > V2
c) V1 > V3 > V2
d) V2 > V1 > V3
e) V1 > V2 > V3
Note e adote:
Massa molar (g/mol):
Mg ...... 24
Fe ....... 56
Sn ....... 119
Considere as afirmações abaixo, sobre essa reação.
I.
A etapa determinante da velocidade da reação é a etapa
2.
II. A reação é exotérmica.
III. A energia de ativação da etapa 1 é maior que a energia
de ativação da etapa 2.
Quais estão corretas?
a) Apenas I.
b) Apenas II.
c) Apenas III.
d) Apenas II e III.
e) I, II e III.
19 - (UNCISAL)
O trióxido de enxofre (SO3) pode ser obtido através da
oxidação do dióxido de enxofre, utilizando um catalisador. Na
atmosfera, a emissão de grande quantidade de enxofre na
forma do gás SO2, subproduto de combustíveis fósseis, sofre
nova oxidação, formando SO3. Esse SO3 reage com água,
formando o ácido sulfúrico que aumenta a acidez da água da
chuva. Dado o diagrama abaixo referente ao equilíbrio SO2(g)
+ O2(g) SO3(g),
16 - (PUC MG) Considere a reação A( g ) B(g) C(g) , que possui
uma energia de ativação de 220 kJ e uma variação de entalpia
H=45KJ. A energia de ativação de decomposição da espécie C é:
a)
b)
c)
d)
45 kJ
220 kJ
175 kJ
265 Kj
17 - (IFGO) Os catalisadores são substâncias utilizadas com o
intuito de acelerar a velocidade das reações químicas. De uma
forma geral, esses compostos não são consumidos durante as
-3-
Colégio Delta
www.colegiodelta.com.br
a adição de um catalisador
a)
b)
c)
d)
e)
diminui apenas a energia de ativação.
diminui apenas a entalpia dos produtos.
aumenta a entalpia dos reagentes e dos produtos.
diminui a energia de ativação e a entalpia dos produtos.
aumenta a energia de ativação e a entalpia dos
reagentes.
20 - (FGV SP) Os automóveis são os principais poluidores dos
centros urbanos. Para diminuir a poluição, a legislação obriga o uso
de catalisadores automotivos. Eles viabilizam reações que
transformam os gases de escapamento dos motores, óxidos de
nitrogênio e monóxido de carbono, em substâncias bem menos
poluentes.
Os catalisadores __________ a energia de ativação da reação no
sentido da formação dos produtos, __________ a energia de
ativação da reação no sentido dos reagentes e __________ no
equilíbrio reacional.
No texto, as lacunas são preenchidas, correta e
respectivamente, por:
a) diminuem … aumentam … interferem
b) diminuem … diminuem … não interferem
c) diminuem … aumentam … não interferem
d) aumentam … diminuem … interferem
e) aumentam … aumentam … interferem
21 - (IFRS)
A legislação brasileira em vigor determina que os
automóveis devem portar extintores de incêndio do tipo ABC.
Incêndios podem ser definidos como a presença de fogo em local
não desejado. São capazes de provocar, além de prejuízos
materiais, quedas, queimaduras e intoxicações por fumaça. O fogo,
por sua vez, é resultante de uma reação química entre:
• Material oxidável (combustível);
• Material oxidante (comburente);
• Fonte de ignição (energia);
• Reação em cadeia.
Um dos princípios da utilização de processos para a extinção de
incêndios consiste em
a) baixar a energia de ativação da reação de combustão.
b) favorecer a entrada no complexo ativado.
c) diminuir ou impedir o contato entre os reagentes.
d) aumentar a quantidade de choques efetivos entre
combustível e comburente.
e) catalisar a ignição do processo.
22 - (IFPE) A cinética química é parte da química que estuda a
velocidade ou rapidez das reações químicas e, se controlarmos
algumas delas, podemos tirar proveito de seus efeitos, por exemplo,
se você deixa o leite líquido fora da geladeira, em algumas horas
ele pode ficar azedo e, no entanto, se colocado na geladeira, pode
durar dias. Já para cozinhar os alimentos, utilizamos a panela de
pressão porque nela podemos atingir temperaturas maiores que
100ºC, acelerando o cozimento. Para fazer com que as reações
ocorram mais rapidamente, utilizam-se os catalisadores, que são
substâncias aceleradoras da velocidade das reações, mas não são
AM
por elas consumidas. Analise as afirmações abaixo em relação aos
catalisadores.
I.
Os catalisadores aceleram a velocidade das reações
químicas porque diminuem a energia de ativação.
II. Os catalisadores aumentam a massa do produto obtido
na reação.
III. Os catalisadores transformam uma reação direta em uma
reação inversa.
IV. Os catalisadores aumentam as quantidades de calor
liberados ou absorvidos nos processos químicos.
V. Luz e calor também são considerados catalisadores, pois
aceleram a velocidade das reações
É(São) verdadeira(s):
a) Apenas I
b) Apenas I e III
c) Apenas I, II e III
d) Apenas I e V
e) Todas as afirmações
23 - (Unimontes MG) O gás hidrogênio, utilizado em diversas
sínteses industriais, pode ser obtido a partir do gás natural metano
(CH4), pela ação de vapor d’água, que é usado para reagir com
45% do metano (CH4);
catalisador Ni
CH4(g) + H2O(g)
CO(g) + 3 H2(g)
700oC
O restante, 55%, reage com ar:
catalisador Ni
2 CH4(g) + O2(g)
2 CO(g) + 4 H2(g)
Em relação às reações de síntese do gás hidrogênio, é CORRETO
afirmar que ambas:
a) formam os mesmos produtos.
b) ocorrem por catálise não enzimática.
c) ocorrem por processos exotérmicos.
d) são reações de natureza reversível.
24 - (Unimontes MG)
A evaporação consiste em um processo útil em diversas
situações rotineiras utilizadas em laboratório ou indústrias para
aumentar a vida útil dos alimentos. A evaporação,
diferentemente de outros métodos de concentração, permite
concentrar os alimentos líquidos por meio de aquecimento.
Normalmente empregam-se evaporadores que operam à
pressão reduzida. É INCORRETO afirmar que esse processo
a)
b)
c)
d)
constitui um procedimento de eliminação de água por
ebulição.
diminui o período de conservação dos alimentos e de
atividade enzimática.
reduz o peso e volume dos alimentos, facilitando o
armazenamento.
facilita o uso e diversificação de oferta de produtos
alimentícios.
25 - (UNITAU SP)
Analise as afirmativas abaixo sobre teoria das colisões e lei
cinética, e assinale a alternativa que apresenta a(s)
afirmativa(s) CORRETA(S).
-4-
I.
II.
III.
IV.
A velocidade de uma reação química é dependente do
número de choques.
Quanto menor a energia de ativação, maior é a
velocidade da reação química.
O valor de H para uma reação exotérmica é negativo e
o valor de H para uma reação endotérmica é positivo.
A temperatura não influencia a velocidade da reação
química.
Colégio Delta
www.colegiodelta.com.br
a)
b)
c)
d)
e)
Apenas I e II estão corretas.
Apenas II, III e IV estão corretas.
Apenas I e III estão corretas.
Apenas II, e III estão corretas.
Apenas I, II e III estão corretas.
GABARITO:
1) Gab: B
2) Gab: B
3) Gab: 15
4) Gab: D
5) Gab: A
6) Gab: meia-vida da reação: 10 h ; v(sacarose) = 5 10–5 molL–1min–
1
7) Gab:
CaCO3(s) + 2HNO3(aq) Ca(NO3)2(aq) + CO2(g) + H2O(l)
vm = 0,003 mol/min
8) Gab:
a)
NO2 + CO NO + CO2
b)
v kNO2 2
c)
k
d)
v
1,0 10 5
2,5
(0,002) 2
A temperatura é maior. Uma vez que nesse ponto as
concentrações de NO2 e CO são iguais e houve um
aumento na velocidade de reação, ocorreu um aumento
na temperatura da reação.
NO 2
2
9) Gab: E
10) Gab: A
11) Gab: E
12) Gab: C
13) Gab: 05
14) Gab: 13
15) Gab: D
16) Gab: C
17) Gab: D
18) Gab: D
19) Gab: A
20) Gab: B
21) Gab: C
22) Gab: A
23) Gab: B
24) Gab: B
25) Gab: C
-5-
AM