Química
Tema: Cinética química
QA.31 – Cinética química IV
Exercícios de assimilação
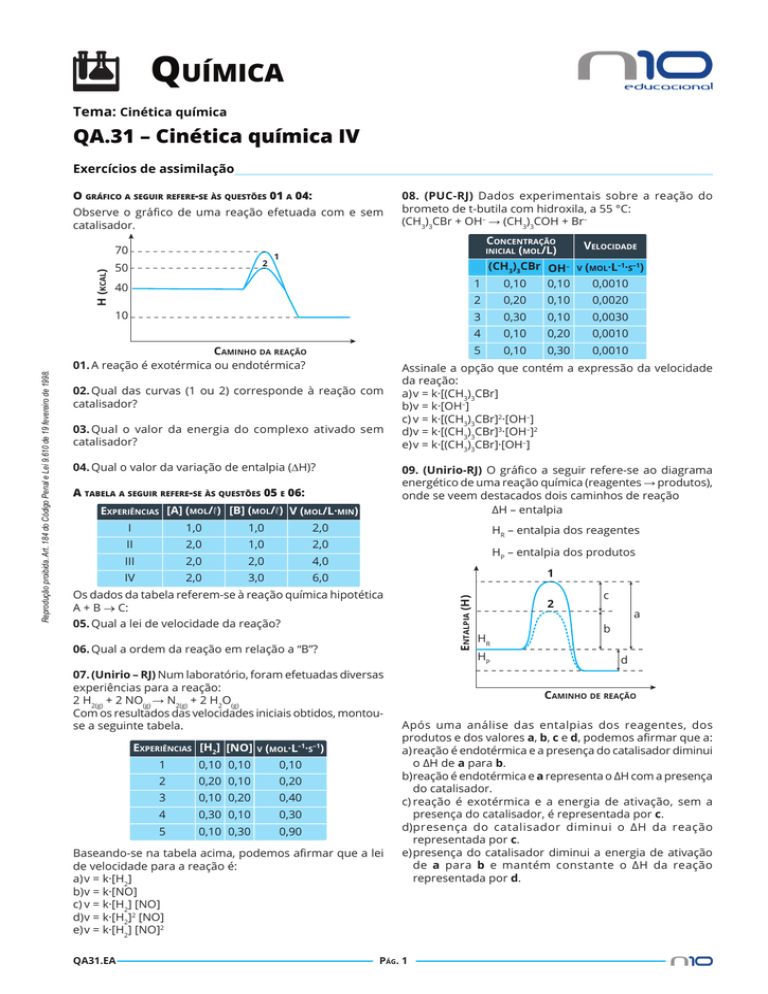
O gráfico a seguir refere-se às questões 01 a 04:
Observe o gráfico de uma reação efetuada com e sem
catalisador.
2
CONCENTRAÇÃO
INICIAL (MOL/L)
1
VELOCIDADE
40
(CH3)3CBr OH–
1
0,10
0,10
2
0,20
0,10
0,0020
10
3
0,30
0,10
0,0030
4
0,10
0,20
0,0010
5
0,10
0,30
0,0010
50
CAMINHO DA REAÇÃO
01.A reação é exotérmica ou endotérmica?
02.Qual das curvas (1 ou 2) corresponde à reação com
catalisador?
03.Qual o valor da energia do complexo ativado sem
catalisador?
04.Qual o valor da variação de entalpia (∆H)?
EXPERIÊNCIAS [A] (MOL/) [B] (MOL/) V (MOL/L·MIN)
1,0
1,0
2,0
II
2,0
1,0
2,0
III
2,0
2,0
4,0
IV
2,0
3,0
6,0
HR – entalpia dos reagentes
HP – entalpia dos produtos
1
Os dados da tabela referem-se à reação química hipotética
A + B → C:
05.Qual a lei de velocidade da reação?
06.Qual a ordem da reação em relação a “B”?
07.(Unirio – RJ) Num laboratório, foram efetuadas diversas
experiências para a reação:
2 H2(g) + 2 NO(g) → N2(g) + 2 H2O(g)
Com os resultados das velocidades iniciais obtidos, montouse a seguinte tabela.
EXPERIÊNCIAS [H2] [NO]
V (MOL·L–1·S–1)
1
0,10 0,10
0,10
2
0,20 0,10
0,20
3
0,10 0,20
0,40
4
0,30 0,10
0,30
5
0,10 0,30
0,90
Baseando-se na tabela acima, podemos afirmar que a lei
de velocidade para a reação é:
a)v = k·[H2]
b)v = k·[NO]
c)v = k·[H2] [NO]
d)v = k·[H2]2 [NO]
e)v = k·[H2] [NO]2
QA31.EA
0,0010
09. (Unirio-RJ) O gráfico a seguir refere-se ao diagrama
energético de uma reação química (reagentes → produtos),
onde se veem destacados dois caminhos de reação
ΔH – entalpia
A tabela a seguir refere-se às questões 05 e 06:
I
V (MOL·L–1·S–1)
Assinale a opção que contém a expressão da velocidade
da reação:
a)v = k·[(CH3)3CBr]
b)v = k·[OH–]
c)v = k·[(CH3)3CBr]2·[OH–]
d)v = k·[(CH3)3CBr]3·[OH–]2
e)v = k·[(CH3)3CBr]·[OH–]
ENTALPIA (H)
Reprodução proibida. Art. 184 do Código Penal e Lei 9.610 de 19 fevereiro de 1998.
H (KCAL)
70
08. (PUC-RJ) Dados experimentais sobre a reação do
brometo de t-butila com hidroxila, a 55 °C:
(CH3)3CBr + OH– → (CH3)3COH + Br–
2
HR
HP
c
a
b
d
CAMINHO DE REAÇÃO
Após uma análise das entalpias dos reagentes, dos
produtos e dos valores a, b, c e d, podemos afirmar que a:
a)reação é endotérmica e a presença do catalisador diminui
o ΔH de a para b.
b)reação é endotérmica e a representa o ΔH com a presença
do catalisador.
c)reação é exotérmica e a energia de ativação, sem a
presença do catalisador, é representada por c.
d)p resença do catalisador diminui o ΔH da reação
representada por c.
e)presença do catalisador diminui a energia de ativação
de a para b e mantém constante o ΔH da reação
representada por d.
Pág. 1
10.(Vunesp – SP) Sobre catalisadores, são feitas as quatro
afirmações seguintes.
I. São substâncias que aumentam a velocidade de uma
reação.
II. Reduzem a energia de ativação da reação.
III. As reações nas quais atuam não ocorreriam nas suas
ausências.
IV. Enzimas são catalisadores biológicos.
Dentre estas afirmações, estão corretas, apenas:
a)I e II.
b)II e III.
c)I, II e III.
d)I, II e IV.
e)II, III e IV.
Reprodução proibida. Art. 184 do Código Penal e Lei 9.610 de 19 fevereiro de 1998.
Gabarito:
01.exotérmica
02.curva 2
03.70 kcal
04.– 30 kcal
05.V = K·[B]
06.ordem 1 ou primeira ordem
07.E
08.A
09.E
10.D
Pág. 2
QA31.EA