QBQ0230 – 2010
Aula 1
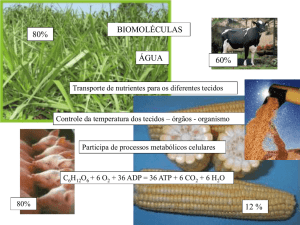
Quais os elementos mais
abundantes nos seres
vivos?
Regina L. Baldini
[email protected]
bloco 12 inferior, sala 1211
Ligações covalentes
Grupos funcionais presentes
em biomoléculas
•
•
•
•
•
•
•
•
•
Hidroxil (álcool)
Carbonil (aldeído e cetona)
Carboxil (ácidos carboxílicos)
Amino
Éster
Tioéster
Éter
Anidrido
...
Água
Ligações
covalentes
Biomoléculas são
compostos de
carbono
Biomoléculas geralmente apresentam
vários grupos funcionais
ÁGUA (H2O)
Qual a molécula mais
abundante nos seres
vivos?
ÁGUA (H2O)
• Propriedades físicas e químicas
importantes para a interações com
biomoléculas
• Ionização
pH
Elétrons estão mais próximos do O, criando um dipolo elétrico
Água pode formar até 4 pontes de H
Pontes de Hidrogênio no gelo
Água líquida:
3,4 ptes H/molécula
Átomo
eletronegativo
H ligado a átomo
eletronegativo
Pontes de H de
importância biológica
Água como solvente
Água como solvente
• Água é polar, portanto dissolve
compostos polares.
• Compostos apolares são insolúveis em
água.
Compostos anfipáticos:
parte polar e parte apolar
Reorganização da água em contato
com um composto apolar ou anfipático
Interações hidrofóbicas no
interior da micela
Formação de
micelas
Interações não covalentes de
biomoléculas com o solvente
Água dissolve sais cristalinos
por hidratação
Kw = [H+] [OH-] = 1x10-14 M2
Ionização da água
• Uma pequena parcela da água ioniza:
• A concentração da água pura é 55,5 M
Exemplo: Qual é a [OH-] em uma
solução 0,1M NaOH?
A escala de pH
• Kw é a base para a escala de pH, que é
um meio conveniente de expressar a [H+]:
(M = m/v.PM )
• Rearranjando na equação:
• pH = log 1 = - log [H+]
[H+]
p significa “logaritmo negativo de”
• Íons hidrônio (H3O+) e hidróxido (OH-)
A escala de pH
A escala de pH
• Para uma solução precisamente neutra a
25oC, na qual [H+] = 10-7 M:
Como os organismos
conseguem manter o pH?
• pH = - log [H+] = 7
Ácidos fortes e fracos
Ácidos e Bases
• Conceito de Bronsted-Lowry
Ácidos são doadores de prótons
Bases são receptores de prótons
HA
H+
+
Constante de dissociação dos ácidos (Ka)
• Ácidos fortes de dissociam completamente
em água
HCl + H2O H3O+ + Cl_
• Ácidos fracos não dissociam completamente
A-
A titulação permite determinar o pka
de um ácido fraco
• Adição de uma base forte e medida do
pH a cada ponto
• Ex: titulação do ácido acético (HAc)
Dois equilíbrios estão envolvidos:
HAc
Quanto menor o ka ou maior o pKa,
mais fraco é o ácido
Kw = 1 x 10-14 M2
H+ + Ac
_
Ka = 1,74 x 10-5 M2
Titulação:
no início, o ácido acético está pouco ionizado
Titulação:
à medida que se adiciona base (OH-), a
ionização aumenta...
Curva de titulação do ácido acético
Curvas de
titulação de
ácidos fracos
Quando pH=pKa, metade
das moléculas de HAc
estão ionizadas
Solução tampão
• Mistura de um ácido e sua base
conjugada, que mantém o pH quando
da adição de pequenas quantidades de
ácido ou base.
•Define o pH de uma solução em termos de:
•pKa do ácido fraco
•Concentração do ácido e sua base conjugada
Tampões biológicos
• Proteínas (aminoácidos têm grupos
ionizáveis)
• Fosfato (H2PO4-)
• Bicarbonato
Manter o pH é importante para a
conformação de proteínas e
atividade de enzimas
Equação de Henderson-Hasselbach