Universidade Federal do Piauí
Centro de Ciências da Natureza
Departamento de Química
Disciplina:
Química Orgânica II
Ministrante:
Prof. Dr. Sidney G. de Lima
Aluno:
E-mail:
Matrícula:
Substiuição Nucleofílica: SN1 e SN2
1. Quais os fatores que influenciam na velocidade das reações do tipo SN1 e SN2
2. O cátion alilico tem um orbital ligante preenchido contendo dois elétrons deslocalizados sobre os
três átomos de carbono e um importante orbital vazio com coeficientes sobre os átomos
terminais. Desenhe esses orbitais moleculares, demonstrando o processo de estabilização.
3. Escreva a equação da lei da velocidade para a reação de hidrólise de haletos primários e
secundários. A lei de velocidade é a mesma para os haletos terciários?
4. Por que um carbocátion metílico não pode ser estabilizado por doação da ligação sigma?
5. Por que um haleto de acila sofre reação SN2 a uma velocidade muito superior a um haleto de
benzila?
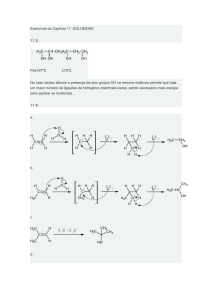
6. Demonstre o mecanismo reacional para a seguinte reação:
Cl
Etanol / Py
C
Cl
O
Éter
Cl
MeOH
Cl
O
OMe
HCl
Cl
O
OH
7. De onde provém a energia necessária para a heterólise dos haletos terciários?
8. Qual a correlação entre a polaridade do solvente e a velocidade de uma reação que se processa
via mecanismos SN1 e SN2?
9. Dada a reação SN2:
H3C
CH2I + N3
H3C
CH2N3 + I-
Explique em que solventes ela ocorre mais rapidamente: metanol ou DMSO?
10. Explique o efeito da estrutura dos haletos (primários, secundários e terciários) na reação de
hidrólise.
11. Dê exemplos de haletos que são difíceis de hidrolisar pelos mecanismos SN1 e SN2.
12. Explique a estereoquímica dos produtos formados via mecanismos SN1 e SN2.
13. Como se faz determinação da configuração relativa?
14. Em que mecanismo de substituição nucleofílica, observa-se a retenção de configuração?
Explique.
15. Quando se deixa 2-iodo-octano opticamente ativo, em solução de acetona com NaI, observa-se
que o haleto apresenta perda de atividade ótica. Mostre o que acontece.
16. A reação a seguir Deve ocorrer mais rapidamente em DMF ou em metanol?
CH3CH2CH2Br +
NaCN
CH3CH2CH2CN + NaBr
17. Explique as afirmações abaixo:
a) Quando brometo de t-butila sofre solvólise, em uma mistura de metanol e água, a velocidade de
solvólise aumenta, quando o percentual de água aumenta.
Universidade Federal do Piauí
Centro de Ciências da Natureza
Departamento de Química
b) Quando cloreto de etila reage com iodeto de potássio, em metanol e água, a velocidade da
reação diminui, quando o percentual de água aumenta.
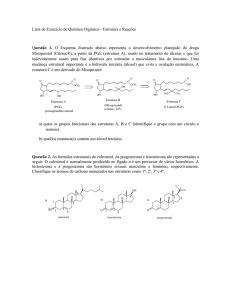
18. Comente sobre o diagrama a seguir:
19. Partindo-se de (S)-2-bromo-butano mostre como preparar:
b) (R)-CH3CH(SCH3)CH2CH3
a) (R)-CH3CH(OCOCH3)CH2CH3
20. Em cada par indique que haleto de alquila reage mais rapidamente pelo mecanismo SN2:
a) Brometo de iso-butila ou brometo de n-propila?
b) Cloreto de n-propila ou brometo de n-propila?
c) Cloreto de etila ou cloreto de vinila?
21. O cloreto de (R)-α-fenil-etila (C6H5CHClCH2CH3), opticamente puro, apresenta (α)= -109; o álcool
(R)-α-fenil-etila (C6H5CHOHCH2CH3), opticamente puro, apresenta (α)= -42,3. Por tratamento do
cloreto (α)= -34, com solução diluída de NaOH, obtém-se o álcool de (α)= +1,7. Calcule:
a) a pureza ótica do reagente e do produto da reação;
b) a porcentagem de retenção e de inversão;
c) a porcentagem de racemização. E de retenção ou de inversão.
22. Quando p-(2-bromoetil)-fenol é cuidadosamente tratado com base, um composto C8H8O é
-1
isolado. Este composto não mostra bandas de absorção no IV acima de 3200 cm , mas
-1
apresenta uma banda forte em 1670 cm e UV máximo em cerca de 230 nm. Em tratamento com
HBr o composto reverte facilmente ao fenol original. Considere estas observações e explique o
que realmente acontece.
23. Em cada caso, indique o mecanismo mais provável da reação de SN1 ou SN2. Escreva o
mecanismo que leva ao produto principal (incluindo a estereoquímica onde for apropriado) e
indique também produtos secundários (sub-produtos) possíveis de serem formados:
a) 3-fenil-1-bromo-propano + NaCN em dimetilformamida.
b) (R)-3-fenil-1-bromo-butano + NaCN em dimetilformamida.
c) (S)-1-fenil-1-bromo-butano + NaCN em dimetilformamida.
d) (S)-1-fenil-1-bromo-butano + AgOAc em etanol.
e) γ,γ-dimetil-alil-tosilato
+ (C2H5)3N em metanol.
f) Ácido-(R)-4-cloropentanóico
+ NaNO2 em água.
g) Ácido-(R)-4-cloropentanóico
+
em ebulição com água.
h) Cloreto de benzila
+
Na2CS3 em acetona.
i) (S)(-)1,3-dibromo-1-fenil-propano em solução aquosa de ácido acético a quente.
j) (S)(-)1,3-dibromo-1-fenil-propano
+
KOAc em dimetilsulfóxido.
Universidade Federal do Piauí
Centro de Ciências da Natureza
Departamento de Química
24. Provão
2000.
19. Provão 2002.
20. ENADE 2008
“Toda a nossa ciência, comparada com a realidade, é
primitiva e infantil e, no entanto,
é a coisa mais preciosa que temos."
Albert Einstein)