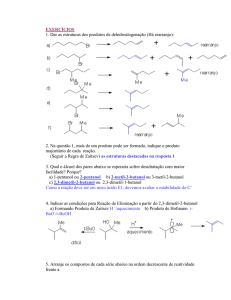
Química Orgânica II – Profa. Rosângela de A. Epifanio
Prova 2 – 16/05/2005
Nome:..............................................................................................................Nota:.............
1) Mesilatos e triflatos são bons grupos de saída. No entanto, o deslocamento de triflato
por um nucleófilo ocorre 5000 vezes mais rápido do que o correspondente mesilato. Em
outras palavras, o triflato é 5000 vezes melhor grupo de saída do que o mesilato. Usando
desenhos e algumas palavras, explique o porque.
O
O
S
O
Nu-
CH3
Nu
velocidade = 1
mesilato
O
O
S
O
Nu-
CF3
Nu
velocidade = 5000
triflato
Resposta: Em ambos os casos a carga negativa do grupo de saída é estabilizada por
ressonância. No caso do triflato os três átomos de flúor fornecem uma estabilização adicional
devido ao seu efeito indutivo retirador de elétrons.
mesilato
O
-O S CH3
O
OO S CH3
O
O
O S CH3
O-
triflato
O
-O S CF3
O
OO S CF3
O
O
O S CF3
O-
O
δO S
δO
F
C
F
F
2) No experimento ilustrado abaixo reagiu-se iodooctano oticamente ativo com iodeto
radioativo. Desta forma foi possível obter a constante de velocidade da reação de
substituição (Ks) e a constant e de velocidade de racemização (Kr)
a) O experimento comprovou que a reação ocorre via substituição nucleofílica
bimolecular. Qual a razão Kr/Ks encontrada? Explique.
b) Caso a reação ocorresse via mecanismo de substituição unimolecular, qual seria a
razão Kr/Ks ? Explique.
H 3C(H2C)5
CH3
H
I
(S)-2-iodooctano
+
128 -
I
I128
H3C(H2C)5
H
CH3
+ I-
(R)-2-iodooctano
Resposta:
a) Quando uma molécula do (S)-2-iodooctano reage, ocorre inversão de configuração via
SN2 e seu enantiômero é formado. A atividade ótica do produto cancela a rotação ótica de
uma molécula do reagente. Deste modo, a reação de uma molécula cancela a rotação ótica
de duas moléculas. Logo Kr = 2 Ks e Kr/Ks = 2
1mol (S)-2-iodooctano
Reagente
+
1 mol (R)-2-iodooctano
= 2 moles racemato
Produto
b) Caso o mecanismo fosse unimolecular, SN1, a etapa lenta da reação seria a formação do
carbocátion intermediário que, sendo planar e aquiral, poderia reagir com o iodeto radioativo
de modo a formar, com igual probabilidade, o (S)-2-iodooctano ou o (R) -2-iodooctano. Logo,
Kr = Ks e Kr/Ks = 1.
Mecanismo hipotét ico SN1
H3 C(H2 C) 5
CH 3
H
I
+
a
+
128 -
lenta
I
H 3C(H 2C)5
b
CH 3
H3 C(H2 C) 5
H
I128
(S)-2- iodooct ano
(S)-2-iodoo ct ano
128 -
CH3
H
+I
b
a
I128
H3 C(H2 C) 5
H
CH 3
(R)-2-iodooctano
1 mol race mato
1mol reagen te
3) a) Usando diagramas de energia/coordenada de reação e algumas palavras explique o
porque que a reação de SN 2 é mais rápida em solvente polar aprótico do que em
solvente polar prótico.
Resposta: Solventes polares próticos (que contêm grupos N-H, O-H ou S-H) solubilizam o
nucleófilo através de ligações hidrogênio e o estabilizam (diminuem sua energia).
Consequentemente, a energia de ativação necessária para chegar ao estado de transição é
maior quando comparada a nucleófilos solvatados com solventes apróticos. Em outras
palavras à energia total da reação soma-se a energia de dessolvatação do nucleófilo.
∆G1±
∆ G2±
Energia
H3C O H
CH 3
O
H
Nu H O CH 3
H
O
Coordenada de reação
CH 3
Linha fina = solvente prótico; Linha grossa = solvente aprótico
b)Usando diagramas de energia /coordenada de reação e algumas palavras explique
porque haletos de alquila terciários reagem mais rápido do que haletos secundários
em condições de SN1
Resposta: As reações SN1 ocorrem através da formação de um intermediário carbocátion.
Sendo esta a etapa lenta da reação, quanto mais estável for o carbocátion e o estado de
transição para sua formação, mais rápida será a reação. Os haletos terciários formam
carbocátions terciários, mais estáveis que os secundários, formados de haletos secundários.
Deste modo, o estado de transição da etapa lenta das reações de haletos terciários é de menor
energia e as reações são, portanto, mais rápidas quando comparadas aquelas com haletos
secundários.
Energia
∆ G1±
Haletos
secundários
∆ G2±
Haletos
terciários
Coordenada de reação
4) A substituição de bromo por hidroxila na substância abaixo é bem mais rápida no
isômero trans do que no cis. Os dois isômeros fornecem o mesmo produto. Explique,
descreva os mecanismos das reações e dê o produto.
CO2H
CO2H
NaOH
OH
Br
produto trans
Resposta: O produto de ambas reações é o trans.
No reagente trans a carboxila e o bromo podem assumir uma conformação antiperiplanar de modo a
ocorrer uma reação nucleofílica interna, mais rápida do que a intermolecular. Nesta reação ocorre inversão
de configuração. O ataque da hidroxila, também SN2, se dá pela face oposta do carboxilato, ocorrendo uma
segunda inversão de configuração e a formação do produto trans.
No reagente cis a carboxila e o bromo não podem assumir uma conformação que permita a reação
intramolecular. Deste modo, ocorre uma única SN2 com ataque da hidroxila e saída do brometo produzindo
o produto trans.
Br
BrCO2H
Br
NaOH
CO2- Na+
CO2H
isômero trans
K1
SN2
produto trans
Lenta
SN2 intramolecular
HO-
OH
CO2H
OH
+ H2O
CO2-
+ NaBr
O
O
CO2H
Br
isômero cis
NaOH
SN2
etapa lenta
k2
CO2H
OH
produto trans
K1>K2 pois a reação intramolecular é mais rápida
5) Complete as reações desenhando os produtos com estereoquímica adequada, quando
for o caso
explicação:
O
OH
O
NaBH 4
a)
MeOH
H
Hataca pela face superior,
menos impedida
H
CH 3
A
b)
1) H2CO, Et 2 O
Mg, Et 2 O
Br
OH
MgBr
2) H3O+
B
O
C
OH
HBr conc.
c)
Br
excesso
D
I
NaOH
d)
E
2 CH3 SO 2Cl
e)
HO
OH Et N, CH Cl
3
2 2
OSO2 CH3
OSO2 CH3
Na2 S, H2O
S
G
DMF
F
OH
f)
Cl
SOCl2
tBuO-Na+
Et2 O
tBuOH
H
I
C6H 12S
H2SO4, MeOH
OMe
J
g)
OH
O
OH
MeO-Na+, MeOH
K
OMe
h)
1) NaOH
SH
2) CH3I
SCH3
L
6) Proponha uma síntese para a substância abaixo
Br
Br
1) Mg, THF
PBr3
2) óxido de etileno
+
3) H3O
OH