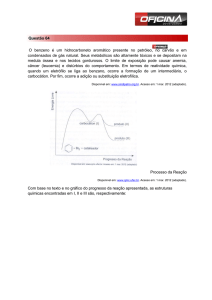
Exercícios do Capítulo 11 -SOLOMONS
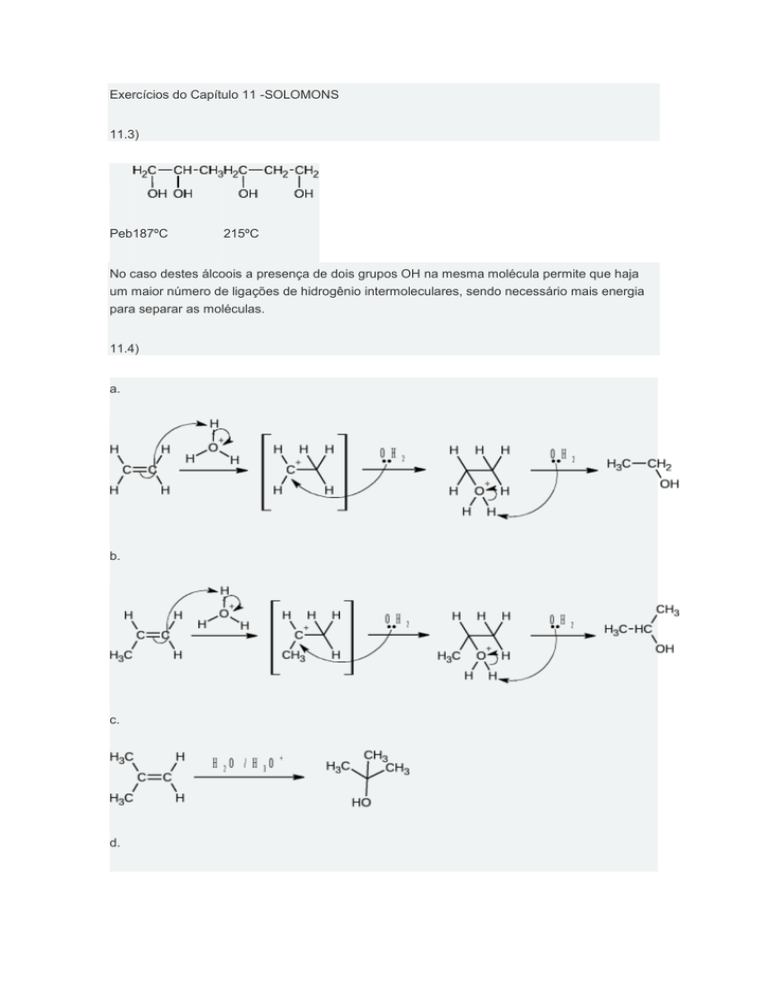
11.3)
Peb187ºC
215ºC
No caso destes álcoois a presença de dois grupos OH na mesma molécula permite que haja
um maior número de ligações de hidrogênio intermoleculares, sendo necessário mais energia
para separar as moléculas.
11.4)
a.
b.
c.
d.
11.5)
O produto formado é o 2,3-dimetil-2-butanol, ele se forma devido ao rearranjo do carbocátion
3ário que é mais estável (menos energético).
11.6)
a.
b.
c.
11.7)
a) Lembre-se que agora não há água no meio, e sim ROH.
b) Preparar éter terc-butil metílico.
11.8)
a. Tributilborano
b.
c.
d.
11.10)
a. 1-pentanol
b. 2-metil-1-pentanol
c. 3-metil-1-pentanol
d. 2-metil-3-pentanol
e. trans-2-metilciclobutanol
11.12)
a.
b.
c.
Somente a reação da letra c não ocorreria pois a base acetato de sódio é muito fraca, não
conseguindo arrancar o próton do álcool.
11.15)
a.
b.
c.
OBSERVAÇÃO:
11,16)
a.
Neste caso a reação ocorre via Sn1 e em álcool terciário o carbocátion formado será o
terciário, que se forma mais rápido que o carbocátion secundário, no caso do álcool
secundário.
b. No caso de álcoois primários e metanol, o mecanismo de reação segue um caminho Sn2,
que será mais rápido se o impedimento estérico for menor. Neste caso o metanol é o que
apresenta menor impedimento estérico, portamto esta reação será a mais rápida.
11.17)
11.18)
Quando se adiciona álcool primário e ácido, a desidratação levaria à formação de um
carbocátion primário, que não se forma. Mas ao se adicionar um álcool terciário ao meio ácido
este imediatamente se transformará em um carbocétion terciário e a reação continua com o
álcool primário levando a um éter assimétrico.
11.19)
1ª.
2ª.
Nos dois casos a reação é uma reação Sn2, portanto, aquela reação em que houver menor
impedimento estérico, maior rendimento terá. No caso acima a primeira alternativa levará a um
rendimento maior.
11.20)
A primeira reação (o álcool reagindo com potássio) não houve quebra de reação no
estereocentro, portanto não houve inversão de configuração. Logo após a formaçaõ do
alcóxido este ataca o brometo de etila, novamente não há reação no estereocentro. Já no caso
da segunda reação, após a formação do tosilato o álcool etílico reage no estereocentro (via
Sn2) levando a uma inversão de configuração.
11.21)
11.22)
a.
b.
Esta reação não ocorre porque não há possibilidade de um ataque por trás (Sn2) no caso do
cis-2-cloroacilexanol.
11.24)
a.
b.
No primeiro caso ocorre uma reação via mecanismo Sn2.
Já no segundo caso a reação ocorre via Sn1, pois há possibilidade de formação de um
carbocátion 3ário.
11.25)
a.
b.
c.
d.
e.
11.26)
Como, neste caso, temos uma base forte atacando, o mecanismo será Sn2, logo o ataque será
no carbono menos substituído, que tem menor impedimento estérico.
11.27)
O primeiro ataque ocorre no carbono marcado, pela base forte (etóxido). Logo em seguida há
uma reaçaõ Sn2 intramolecular com expulsão do cloro e formação do epóxido.
11.28) Para isto basta fazer o ataque ao outro carbono do epóxido.
11.31)
1.
3,3-dimetil-1-butanol
2.
4-penten-2-ol
3.
2-metil-1,4-butenodiol
4.
2-fenil-etanol
5.
1-metil-2-ciclopenten-1-ol
6.
cis-3-metilaciclohexanol
11.32)
d.
a.
b.
e.
c.
f.
g.
i.
h.
j.
11.33)
a)
b)
c.
d.
11.34)
a.
b.
c.
d.
11.35)
a.
b.
c.
d.
e.
11.36)
a.
b.
c.
d.
e.
f.
g.
h.
i.
j.
k.
l.
11.37)
a.
b.
c.
d.
e.
f.
g.
h.
i.
j.
k.
l.
11.38)
a.
b.
c.
d.
11.39)
11.40)
a.
b.
c.
d.
11.41)
a.
b.
c.
11.43)
a.
b. O trans-2-ciclopentanol.
A adição que ocorre é anti, pois o lado em que se forma o epóxido é impedido. Logo, o ataque
será do lado contrário levando ao produto trans.
11.44)
11.45)
a.
b.
c.
d.
11.46)
a.
b.
c.
d.
11.47)
a.
b. São diasteroisômeros, só mudou a disposição dos átomos no espaço.
c.
d.
e.
f.
g. São enantiômeros (R) e (S).
11.48)
a.
b.