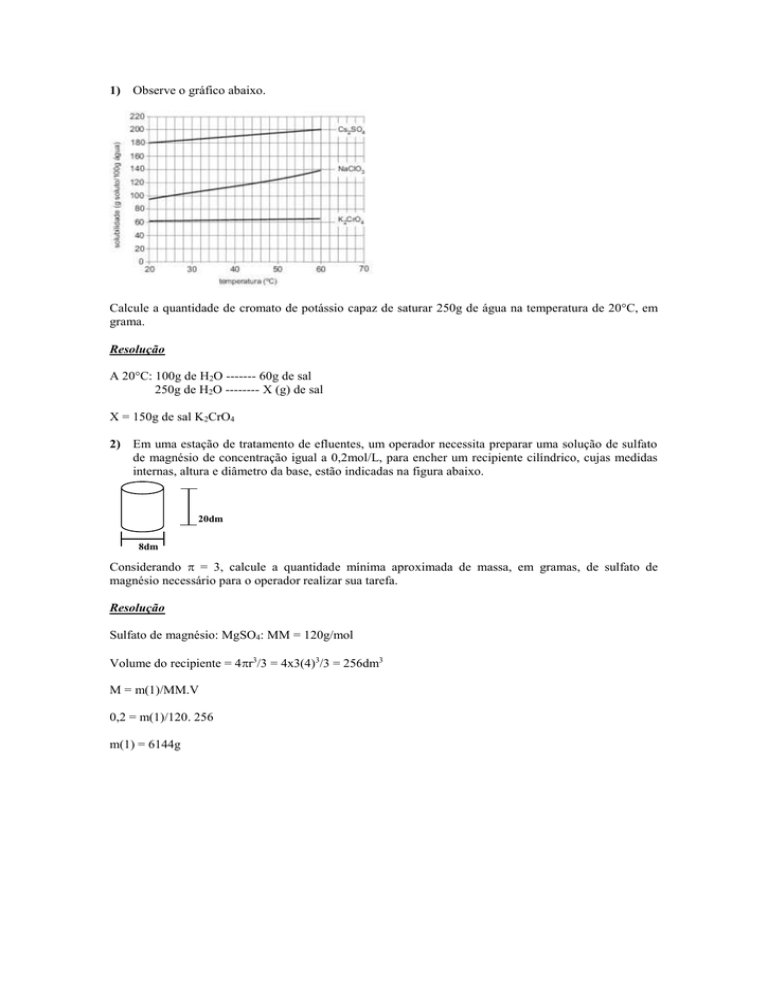
1) Observe o gráfico abaixo.
Calcule a quantidade de cromato de potássio capaz de saturar 250g de água na temperatura de 20°C, em
grama.
Resolução
A 20°C: 100g de H2O ------- 60g de sal
250g de H2O -------- X (g) de sal
X = 150g de sal K2CrO4
2) Em uma estação de tratamento de efluentes, um operador necessita preparar uma solução de sulfato
de magnésio de concentração igual a 0,2mol/L, para encher um recipiente cilíndrico, cujas medidas
internas, altura e diâmetro da base, estão indicadas na figura abaixo.
20dm
8dm
Considerando = 3, calcule a quantidade mínima aproximada de massa, em gramas, de sulfato de
magnésio necessário para o operador realizar sua tarefa.
Resolução
Sulfato de magnésio: MgSO4: MM = 120g/mol
Volume do recipiente = 4r3/3 = 4x3(4)3/3 = 256dm3
M = m(1)/MM.V
0,2 = m(1)/120. 256
m(1) = 6144g
3) Em um laboratório 0,04g de hidróxido de sódio, foram dissolvidos em água suficiente para formar
2000mL de solução cuja densidade é de 1,0g/mL. Calcule a concentração, em g/L, e a porcentagem,
em massa, do soluto.
Resolução
C = m(1)/V
C = 0,04/2 = 0,02g/L
C = 10. d. P
0,02 = 10.1.P
P = 0,002 = 0,2%
4) Observe o gráfico abaixo.
A quantidade de clorato de sódio capaz de atingir a saturação em 500 g de água na temperatura de 60 °C,
em grama, é aproximadamente igual a:
a)
b)
c)
d)
e)
70
140
210
480
700
5) O coeficiente de solubilidade de um sal inorgânico é de 60 gramas por 100 gramas de água a 80C. A
massa em gramas desse sal, nessa temperatura, necessária para saturar 80g de H2O é:
a)
b)
c)
d)
e)
24
48
60
80
96
6) Dissolve-se 8,8g de ácido ascórbico (vitamina C, C6H8O6) em água suficiente para preparar 125mL
de solução.
A concentração molar deste componente na solução é:
a)
b)
c)
d)
e)
0,10
0,20
0,40
0,80
1,00
7) O gráfico abaixo, que mostra a variação da solubilidade do dicromato de potássio na água em função
da temperatura, foi apresentado em uma aula de química sobre misturas e suas classificações.
Solubilidade (g de soluto/100g H2O)
60
20
30
Temperatura (˚C)
70
Em seguida, foram preparadas seis misturas sob agitação energética, utilizando dicromato de potássio
sólido e água em diferentes temperaturas, conforme o esquema a seguir:
Após a estabilização dessas misturas, o número de sistemas homogêneos e o número de sistemas
heterogêneos formados correspondem, respectivamente a:
a)
b)
c)
d)
e)
5–1
4–2
3–3
1–5
2–4
8) Evapora-se totalmente o solvente de 250mL de uma solução aquosa de MgC2 de concentração
8,0g/L. Quantos gramas de MgC2 são obtidos ?
a)
b)
c)
d)
e)
8,0
6,0
4,0
2,0
1,0
9) O permanganato de potássio pode ser utilizado como germicida no tratamento de queimaduras. É um
sólido brilhante e usado, habitualmente, como reagente comum nos laboratórios.
Considere a dissolução em meio ácido de 0,395g deste sal em água suficiente para produzir 250mL de
solução. A molaridade da solução resultante ê:
a)
b)
c)
d)
e)
0,01 M
0,02 M
0,03 M
0,04 M
0,05 M
10) Quantos gramas de NaC existem em 400g de soro caseiro a 9% em massa de soluto.
a)
b)
c)
d)
e)
3,60g
36,0g
360,0g
364,0g
396,4g
11) Os frascos a seguir contêm soluções saturadas de cloreto de potássio (KC) em duas temperaturas
diferentes. Na elaboração das soluções foram adicionados, em cada frasco, 400mL de água e 200g de
KC.
O diagrama a seguir representa a solubilidade do KC em água, em gramas de soluto/100mL de H2O, em
diferentes temperaturas.
Determine a temperatura do frasco I e a quantidade de sal dissolvido (KC) no frasco II.
a)
b)
c)
d)
e)
20°C e 80g
60°C e 80g
80°C e 80g
60°C e 120g
80°C e 120g
12) A concentração de cloreto de sódio na água do mar é, em média, de 2,95g/L. Assim sendo, a
concentração molar desse sal na água do mar é aproximadamente de:
(Dado: massa atômica do Na = 23; C = 35,5)
a)
b)
c)
d)
e)
0,050
0,295
2,950
5,000
5,850
13) Para a prevenção de cáries, em substituição à aplicação local de flúor nos dentes, recomenda-se o
consumo de “água fluoretada”. Sabendo que a percentagem, em massa, de fluoreto de sódio na água
é de 2x10-4%, um indivíduo que bebe 1 litro de água, diariamente, terá ingerido uma massa desse
igual a: (densidade da água fluoretada: 1,0g/mL).
a)
b)
c)
d)
e)
2x10-3g
3x10-3g
4x10-3g
5x10-3g
6x10-3g
14) No rótulo de uma garrafa de água mineral, lê-se:
Conteúdo
Sais minerais
Nitrato de sódio
- 1 litro
composição
17,00 mg
Nessa água mineral, a concentração de íons nitrato – (NO3-1) – em mol.L-1 corresponde a:
a)
b)
c)
d)
e)
1,0x10 -4
2,0x10 -4
4,0x10 -2
8,5x10 -2
9,8x10-2
15) Para prepara 250mL de solução 0,1M, a quantidade necessária, em gramas, de permanganato de
potássio é:
a)
b)
c)
d)
e)
0,877g
3,950g
15,80g
39,50g
158,0g
16) Os intervalos de tempo entre as doses dos medicamentos são calculados para garantir que a
concentração plasmática do princípio ativo seja mantida entre um valor mínimo eficaz e um valor
máximo seguro.
Para certo medicamento, o princípio ativo apresenta massa molar de 200g e sua concentração plasmática
reduz-se à metade a cada 8 horas.
O valor mínimo eficaz da concentração plasmática é igual a 1.10 −5mol.L−1 e seu valor máximo seguro é
de 9,5.10−5mol.L−1.
A concentração plasmática máxima atingida imediatamente após a ingestão da primeira dose é igual a
16mg.L−1.
Nessas condições, o intervalo de tempo ideal, em horas, entre a ingestão da primeira e da segunda dose é
de:
a)
b)
c)
d)
e)
24
12
6
3
1
17) Em um balão volumétrico de 500mL colocaram-se 9,5g de MgC2 e completou o volume com água
destilada. Sabendo-se que o MgC2 foi totalmente dissolvido, identifique a concentração aproximada
de íons Mg+2 nessa solução:
(Dados M.A : Mg = 24; C = 35,5)
a)
b)
c)
d)
e)
0,05 M
0,10 M
0,20 M
0,40 M
3,20 M
18) Para obter uma concentração de íons sódio (Na+) igual a 0,05mol/L, um químico preparou 80mL de
solução de Na2SO4. Calcule a massa, em mg, utilizada por esse química para obter a concentração
iônica desejada.
19) Calcule o valor da concentração, em quantidade de matéria/L, de etanol em uma amostra 100mL de
gasolina, combustível que contém 25% de etanol, em volume, sabendo que a densidade do etanol é
0,80g.mL−1.
20) Os medicamentos atualmente conhecidos como genéricos apresentam, em sua composição,
substâncias equivalentes às das marcas tradicionais, com preços mais baixos.
Para estimular o crescimento das crianças, recomenda-se a ingestão de comprimidos que contêm
2,43x10-2g de ZnO, por comprimido.
O medicamento genérico utilizado em substituição ao comprimido tradicional apresenta a seguinte
composição:
Solução aquosa de ZnSO4
de concentração igual a 0,10 mol.L-1
Calcule o volume necessário da solução de ZnSO4, em mL, para a ingestão da mesma massa de Zn+2
contida em um comprimido do medicamento tradicional.












