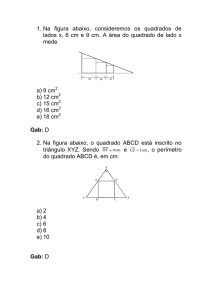
Lista 2º ano Prof Saulo Godoy
01 - (PUC SP/2016)
O ânion bromato reage com o ânion brometo em meio ácido
gerando a substância simples bromo segundo a equação:
BrO3– (aq) + 5 Br– (aq) + 6 H+ (aq) 3 Br2(aq) + 3 H2O(l)
A cinética dessa reação foi estudada a partir do
acompanhamento dessa reação a partir de diferentes
concentrações iniciais das espécies
BrO3– (aq), Br– (aq) e H+ (aq).
b)
c)
d)
e)
O íon I–(aq) atua aumentando a energia de ativação.
A água é o complexo ativado da reação.
A lei de velocidade do processo é v = k [H2O2]2.
A segunda etapa é a determinante da velocidade.
04 - (UFJF MG/2015)
Alguns óxidos gasosos de nitrogênio e carbono são poluentes
atmosféricos. A reação de NO2 com monóxido de carbono gera
NO e dióxido de carbono. Em um estudo cinético dessa
reação, foram obtidos os seguintes dados para a velocidade
da reação química em função das concentrações iniciais dos
reagentes:
Ao analisar esse processo foram feitas as seguintes
observações:
I.
Trata-se de uma reação de oxidorredução.
II.
O ânion brometo (Br–) é o agente oxidante do
processo.
III.
A lei cinética dessa reação é v = k[BrO3–][Br–][H+]2.
Pode-se afirmar que estão corretas
a)
b)
c)
d)
I e II, somente.
I e III, somente.
II e III, somente.
I, II e III.
02 - (UEPG PR/2015)
Considerando a seguinte reação genérica:
a)
Escreva a equação química balanceada que
representa essa reação.
b)
Qual é a lei de velocidade para essa reação química?
c)
Qual é o valor da constante de velocidade dessa
reação a 350 K? Apresente os cálculos.
d)
A temperatura da reação na última linha da tabela
acima é maior, menor ou igual às outras três temperaturas de
reação? Justifique sua resposta.
05 - (UEPA/2015)
De um modo geral, a ordem de uma reação é importante para
prever a dependência de sua velocidade em relação aos seus
reagentes, o que pode influenciar ou até mesmo inviabilizar a
obtenção de um determinado composto. Sendo assim, os
dados da tabela abaixo mostram uma situação hipotética da
obtenção do composto “C”, a partir dos reagentes “A” e “B”.
3Z + 2Y 4X
As etapas do mecanismo dessa reação estão abaixo
representadas:
2Z + Y W (lenta)
Y + W K (rápida)
K + Z 4X (rápida)
01.
Se duplicar a concentração de Z, a velocidade
quadruplica.
02.
Se duplicar a concentração de Y, a velocidade dobra.
04.
A ordem da reação é 3.
08.
Se triplicar simultaneamente as concentrações de Z e
Y, a velocidade da reação ficará 27 vezes maior.
16.
A expressão da lei da velocidade da reação é a
seguinte: v=k[Z].[Y].
03 - (FCM PB/2015)
Conhecer os fundamentos teóricos da cinética química é de
grande importância, principalmente para as indústrias
químicas. Afinal, acelerando-se as reações, reduz-se o tempo
gasto com a produção, tornando os processos químicos mais
econômicos e os produtos finais mais competitivos no
mercado. Com relação à cinética das reações, considere o
mecanismo abaixo da reação de decomposição do peróxido
de hidrogênio em presença de íons iodeto.
Etapa 1: H2O2(aq)+ I–(aq) H2O(l) + IO–(aq)
(lenta)
Etapa 2: H2O2(aq) + IO–(aq) H2O(l) + O2(g) + I–(aq)
(rápida)
Com base no mecanismo, assinale a alternativa correta.
a)
O íon IO–(aq) é o intermediário da reação.
A partir dos dados da tabela acima, é correto afirmar que a
reação: A + B C, é de:
a)
2ª ordem em relação a “A” e de ordem zero em
relação a “B”
b)
1ª ordem em relação a “A” e de ordem zero em
relação a “B”
c)
2ª ordem em relação a “B” e de ordem zero em
relação a “A”
d)
1ª ordem em relação a “B” e de ordem zero em
relação a “A”
e)
1ª ordem em relação a “A” e de 1ª ordem em relação
a “B”
06 - (UNITAU SP/2015)
A reação química abaixo foi estudada, e os resultados
experimentais obtidos estão descritos na tabela abaixo.
aA + bB xX
É correto dizer que
a)
b)
c)
d)
e)
A partir dos dados acima, o valor da constante de velocidade
da reação é
a)
b)
c)
d)
e)
5,0 x 10–2
7,5 x 10–2
2,5 x 10–2
1,0 x 10–2
0,5 x 10–2
07 - (FGV SP/2014)
Para otimizar as condições de um processo industrial que
depende de uma reação de soluções aquosas de três
diferentes reagentes para a formação de um produto, um
engenheiro químico realizou um experimento que consistiu em
uma série de reações nas mesmas condições de temperatura
e agitação. Os resultados são apresentados na tabela:
Após a realização dos experimentos, o engenheiro pode
concluir corretamente que a ordem global da reação estudada
é igual a
a)
b)
c)
d)
e)
1.
2.
3.
4.
5.
08 - (Mackenzie SP/2014)
No estudo cinético do processo químico equacionado por
apenas I e III são verdadeiras.
apenas I e II são verdadeiras.
apenas I é verdadeira.
apenas II é verdadeira.
apenas III é verdadeira.
09 - (UNIUBE MG/2014)
No estudo das velocidades das reações, conceitua-se a ordem
de reação como a soma dos expoentes aos quais estão
elevadas as concentrações na expressão de velocidade, não
sendo associada aos coeficientes da reação. Qualquer
hipótese levantada sobre uma reação química em nível
molecular deverá, obrigatoriamente, concordar com a lei de
velocidade, pois ela é proposta única e exclusivamente com
base em dados experimentais. Imagine que um grupo de
estudantes queira determinar a ordem de reação para os
reagentes da reação entre gás oxigênio e monóxido de
nitrogênio, formando dióxido de nitrogênio, representada
abaixo.
O2(g) + 2 NO(g)
2 NO2(g)
V = K.[O2]a.[NO]b
Para a determinação dos valores de “a” e “b”, os alunos
realizaram 4 experimentos cujos dados são mostrados na
tabela abaixo.
De acordo com as informações dadas e os conceitos sobre
cinética química, a ordem de reação em relação ao O2, NO e
a expressão da velocidade para a reação são,
respectivamente:
a)
b)
c)
d)
e)
1; 1 e V = K.[O2].[NO]
2; 1 e V = K.[O2]2.[NO]
2; 2 e V = K.[O2]2.[NO]2
1; 1 e V = K.[O2]2.[NO]2
1; 2 e V = K.[O2].[NO]2
10 - (UERN/2014)
No estudo cinético da reação representada por: X + Y Z
foram encontradas as seguintes variações de concentração e
velocidade em um intervalo de tempo:
A(g) + B(g) + C(g) D (g),
foram realizados experimentos a uma dada temperatura T,
por meio dos quais foram obtidos os dados que se encontram
na tabela abaixo:
Analisando os resultados, a expressão correta da Lei da
Velocidade para essa reação é:
A partir desses dados, foram feitas as seguintes afirmações:
I.
Trata-se de um processo de ordem global igual a 3.
II.
A expressão da velocidade cinética do processo é
dada por v = k[A][B][C].
III.
O valor da constante de proporcionalidade k, na
temperatura T, é de 0,01.
a)
b)
c)
d)
v = k . [x]2 . [y]2
v = k . [x]3 . [y]3
v = k . [x]3 . [y]2
v = k . [x]2 . [y]3
11 - (UFGD MS/2014)
Em uma reação química hipotética X + Y Produto, obtevese, experimentalmente, os dados apresentados na Tabela:
Velocidade de
Experiment o
Com os dados apresentados, indique a alternativa correta para
a equação de velocidade desta reação.
a)
b)
c)
d)
e)
v=k
v = k.[X]
v= k.[X].[Y]
v = k.[X]2.[Y]3
v = k.[Y]
[NO] inicial [H 2 ] inicial
(mol L-1 )
(mol L-1 )
consumo inicial
de NO
1
4,0 x 10 -3
2,0 x 10 -3
(mol L-1 s -1 )
1,2 x 10 -5
2
8,0 x 10
-3
2,0 x 10 -3
4,8 x 10 -5
4,0 x 10
-3
-3
2,4 x 10 -5
3
4,0 x 10
De acordo com esses resultados, é correto concluir que a
equação de velocidade é
12 - (UNITAU SP/2014)
Os dados da tabela abaixo referem-se ao processo químico: X
+ Y + Z W. Para esse processo, assinale a alternativa que
apresenta CORRETAMENTE a expressão da velocidade e a
ordem da reação em relação a X, Y e Z.
a)
b)
c)
d)
e)
v = k [NO] [H2]2
v = k [NO]2[H2]2
v = k [NO]2[H2]
v = k [NO]4[H2]2
v = k [NO]1/2[H2]
15 - (UFT TO/2012)
Considere a equação para a reação de obtenção do dióxido de
nitrogênio:
2NO(g) + O2(g) 2NO2(g)
A tabela a seguir apresenta dados obtidos experimentalmente
para determinação da cinética de reação do dióxido de
nitrogênio à temperatura de 400ºC.
a)
ordem
b)
ordem
c)
d)
ordem
e)
v = k [X]2 [Z]3, X: 2ª ordem, Y: ordem zero, Z: 3ª
v = k [X] [Y] [Z]3, X: 1ª ordem, Y: 1ª ordem, Z: 3ª
A ordem global da reação é:
v = k [X] [Z]3, X: 1ª ordem, Y: ordem zero, Z: 3ª ordem
v = k [X]2 [Y]2×[Z]2, X: 2ª ordem, Y: 2ª ordem, Z: 2ª
a)
b)
c)
d)
e)
v = k [X] [Y]3, X: 1ª ordem, Y: 3ª ordem, Z: ordem zero
13 - (UNIFOR CE/2013)
Para a reação entre os gases abaixo, obtiveram-se os
seguintes dados sobre a velocidade inicial com respeito à
concentração inicial (mol/L) dos reagentes:
4
3
2
1
0
16 - (UFGD MS/2012)
Para a reação 2NO(g) + O2 (g) 2NO2 (g) foram obtidos os
seguintes dados cinéticos:
2H2 + 2NO N2 + 2H2O
[H 2 ]
1,8 10 3
[ NO]
1,2 10 3
Velocidade (mol/L.min )
3 10 5
3,6 10 3
3,6 10 3
3,6 10 3
1,2 10 3
2,4 10 3
3,6 10 3
6 10 5
24 10 5
X
Pode-se dizer que a expressão da velocidade da reação e a
velocidade da reação no ponto ‘X’ indicado são:
a)
b)
c)
d)
e)
V = k [ NO] [H2], v = 48 10–5
V = k [ NO]2 [H2], v = 54 10–5
V = k [ NO] [H2]2, v = 72 10–5
V = k [ NO] [H2]2, v = 96 10–5
V = k [ NO]2 [H2], v = 72 10–5
14 - (UFPA/2012)
Os resultados de três experimentos, feitos para encontrar a lei
de velocidade para a reação 2 NO(g) + 2 H2(g) N2(g) + 2
H2O(g), encontram-se na Tabela 1 abaixo.
Tabela 1 – Velocidade inicial de consumo de NO(g)
Analisando a tabela, é correto afirmar que
a)
a expressão da velocidade da reação é v =
k[NO]2.[O2].
b)
a temperatura do último experimento é 400 ºC.
c)
a velocidade da reação independe da concentração
de O2.
d)
o valor da constante de velocidade (k) a 400 ºC é
1L.mol–1.
e)
o valor da constante de velocidade (k) é o mesmo em
todos os experimentos.
17 - (UFG GO/2011)
A amônia é matéria-prima para a fabricação de fertilizantes
como a ureia (CON2H4), o sulfato de amônio [(NH4)2SO4)] e o
fosfato de amônio [(NH4)3PO4]. A reação de formação da
amônia se processa em duas etapas, conforme equações
químicas fornecidas abaixo.
N2 (g) + 2 H2 (g) N2H4 (g) (1) lenta
N2H4 (g) + H2 (g) 2 NH3 (g) (2) rápida
15) Gab: B
16) Gab: A
Dessa forma, a velocidade da equação global N2 (g) + 3 H2 (g)
2 NH3 (g) é dada pela seguinte expressão:
a)
b)
c)
d)
e)
18) Gab:
a)
v = 8[A][B][C]2
b)
1,2810–2 mol L–1 s–1.
v = k [N2] [H2]2
v = k [NH3]2
v = k [N2] [H2]3
v = k [NH3]2/[N2] [H2]3
v = k [N2H4]/[N2] [H2]2
18 - (UFC CE/2010)
A tabela abaixo apresenta os resultados obtidos para o estudo
cinético de uma reação química elementar genérica na forma
aA + bB + cC
D + E.
Experiment o
[A]
[B]
[C]
Velocidade
1
mol.L-1s-1
0,10 0,10 0,10 8,0.10 4
2
0,20 0,10 0,10
1,6.103
3
0,10 0,20 0,10
1,6.103
4
0,10 0,10 0,20
3,2.103
A partir destes resultados, determine:
a)
a lei de velocidade da reação.
b)
o valor da velocidade da reação quando [A] = [B] = [C]
= 0,20 mol L-1
GABARITO:
1) Gab: B
2) Gab: 15
3) Gab: A
4) Gab:
a)
NO2 + CO NO + CO2
b)
v kNO2 2
k
v
5) Gab: A
6) Gab: C
7) Gab: C
8) Gab: A
9) Gab: E
10) Gab: D
11) Gab: C
12) Gab: A
13) Gab: B
14) Gab: C
NO 2
2
1,0 10 5
2,5
(0,002) 2
d)
A temperatura é maior. Uma vez que nesse ponto as
concentrações de NO2 e CO são iguais e houve um aumento
na velocidade de reação, ocorreu um aumento na temperatura
da reação.
c)
17) Gab: A