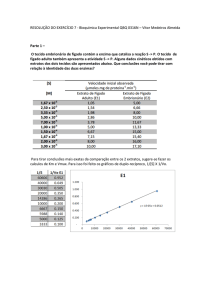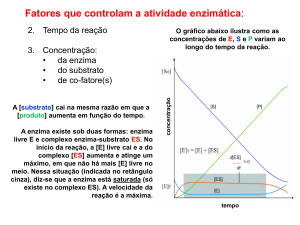
Enzimas como Catalisadores
A
Espontaneidade vs. Velocidade de Reações
B
A
B
Reações espontâneas liberam energia - exergônicas
Diamante
Glicose
Reações exergônicas precisam ultrapassar
barreira energética
Grafite
+ 02
CO2
Velocidade das reações depende da
Energia de Ativação
1
Enzimas reduzem energia de ativação
Enzimas alteram velocidade sem alterar Keq
A
Reação não-catalizada
B
Reação catalizada
por enzima
Enzimas criam um caminho
alternativo para a reação !
Classificação das enzimas
Poder catalítico das enzimas
Aumento da velocidade da reação:
2
Estratégias gerais de catálise
Aproximação e
orientação dos
substratos
Rearranjo
eletrônico
no substrato
Tensionamento
do substrato
Complementariedade Enzima-Substrato
Chave-Fechadura
Grupos ionizáveis promovem catálise
sem
catálise
catálise
ácida
catálise
básica
catálise
ácida e básica
Ajuste Induzido
“Ajuste Induzido”
Complementariedade garante grande especificidade!
3
Sítio ativo define especificidade
O sítio ativo da quimotripsina
Reação catalisada pela quimotripsina:
O
-C NH
+ H2O
O
-C OH
+
H2 N-
Atividade
O
-C NH
+++
O
-C NH
+/ -
Existe também complementariedade
de interações entre sítio ativo e substrato
Quimotripsina
Efeito do pH na atividade enzimática
Quimotripsina + substrato (Gly-Ala-Trp)
4
pH Influences Chymotrypsin Activity
Quimotripsina utiliza catálise ácido-básica
Relative Activity
Quimotripsina
:
H
R1
COOH
H2O
5
6
7
8
9
10
11
pH
Adapted from Dressler & Potter (1991) Discovering Enzymes, p.162
pH 6
N
H–O–CH2
C C
H
CH2
Ser
195
His 57
O
C–O–H
Asp 102
N
H
Active Ser
C
- O–CH
N–H
C C
H
CH2
His 57
2
Ser
195
H
H–N
C
C
+
N–H
H+
H–N
C
C
H
O
C–O Asp 102
pH 8
H
H
=
C
Adapted from Alberts et al (2002) Molecular Biology of the Cell (4e) p.158
=
Asp 102
H–N
H–N
C
C
N
C
H
Inactive
+
N–H H–O–CH2
C C-H
CH2
Ser
195
Adapted from Dressler & Potter (2000) Discovering Enzymes, p.163
H
O
C–O -
=
Charge Relay in Active Site
Imidazole on Histidine Is Affected by pH
His 57
Adapted from Alberts et al (2002) Molecular Biology of the Cell (4e) p.158
5
Enzimas requerem co-fatores
Metais: Ca2+, Mg2+, Mn2+, Fe2+, Cu2+, Ni2+, Co2+, Zn2+, etc...
Coenzimas: moléculas orgânicas, derivados de vitaminas
Co-fatores realizam reações químicas que as cadeias
laterais dos aminoácidos não seriam capazes de realizar.
Exs.: transferência de grupos, óxido-redução
Coenzimas envolvidas em reações de
óxido-redução
NAD+
nicotinamida adenina dinucleotídeo
Outros co-fatores envolvidos
em óxido-redução:
NADP, FAD, Metais
Coenzimas envolvidas em reações de
transferência de grupo
Atividade de enzimas no plasma e diagnóstico
6
Atividade de enzimas no plasma e diagnóstico
Comportamento cinético das enzimas
Cinética : estuda velocidade de reações
Velocidade
velocidade máxima
Concentração de substrato
Diferença entre reações catalizadas por enzimas
e reações não catalizadas por enzimas
Por que enzimas exibem comportamento
hiperbólico ?
Velocidade máxima - Vmax
substrato
substrato
Velocidade inicial – V0
Enzimático
Velocidade
Não-enzimático
Enzima está
saturada : mais
substrato do que
ela consegue processar
em um certo instante
Concentração de substrato
7
Teoria de Michaelis-Menten
E+
E
S
ES
k2
V0 = Vmax [S]
KM + [S]
k3
E+P
velocidade inicial - V0
velocidade máxima - Vmax
constante de Michaelis - KM
Medida de velocidades iniciais (v0):
Concentração
2
3
4
5
6
7
8
S
+
E
↓
P
60
40
20
k4
S
1
80
+P
Produto
E+S
k1
E
S
0
0
0
4
6
8
Substrato (mole)
Juang RH (2004) BCbasics
Equação de Michaelis-Menten (I)
E+S
P
2
k1
ES
k2
k3
E+P
k4
Premissa: primeira metade mais rápida que segunda
V = k3 [ES] – k4 [E] [P]
V0 = k3 [ES]
E
ES
No equilíbrio estacionário [ES] = cte
tempo
V0 são medidas em tempos iniciais da reação
Período de tempo em que [ES] é constante: equilíbrio estacionário
Logo, neste período velocidade da reação é constante!
(Reações que criam e desfazem ES ocorrem com mesma velocidade)
k3 [ES] + k2 [ES] = k1 [E][S]
Juang RH (2004) BCbasics
8
Equação de Michaelis-Menten (II)
Equação de Michaelis-Menten (III)
k3 [ES] + k2 [ES] = k1 [E][S]
V0 = Vmax [S]
k2 + k3 + [S]
k1
k2 + k3
k1
CENSURADO
V0 = Vmax [S]
KM + [S]
V0 = Vmax [S]
k2 + k3 + [S]
KM
Constante de
Michaelis
KM e Vmax revelam
características importantes
de uma enzima:
KM indica afinidade
Vmax indica veloc. de catálise
k1
O significado do KM
Caso especial de Michaelis-Menten
V0 = Vmax
[S]
[S] + KM
V0 = Vmax/2
K M = k2 + k3
Vmax = Vmax [S]
2
KM + [S]
k1
Se k2 >> k3
KM =
k2
k1
= Kd(ES)
1 =
2
[S]
KM + [S]
KM + [S] = 2 [S]
KM é uma medida da afinidade pelo substrato !
É uma propriedade intrínseca da enzima e por isso constante !
[S] = KM
A concentração de substrato na qual V0
= Vmax/2 é numericamente igual ao KM
9
O significado de Vmax
V0 = k3 [ES]
se [ES] ~ [Et]
Velocidade é proporcional à concentração
de enzima
v = k3 [ES]
V0 ~ Vmax
Vmax = k3 [Et]
k3 = Vmax
[Et]
k3 = kcat
Número de moléculas
de produto produzidas
por uma molécula de
enzima em um segundo
constante catalítica ou número de renovação
Vmax não é uma cte. mas permite deduzir uma cte.!
Atividade de enzimas no plasma e diagnóstico
Transformação da equação de
Michaelis-Menten
V0 = Vmax
[S]
[S] + KM
1
K + [S]
= M
V0 Vmax [S]
CENSURADO
1
KM
+
[S]
=
V0 Vmax [S]
Vmax [S]
1
K
1 +
= M
V0 Vmax [S]
1
Vmax
10
O gráfico Duplo-Recíproco
ou Lineweaver-Burke
1
K
1 +
= M
V0 Vmax [S]
y =
ax
+
1
Vmax
b
11